Osmose - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
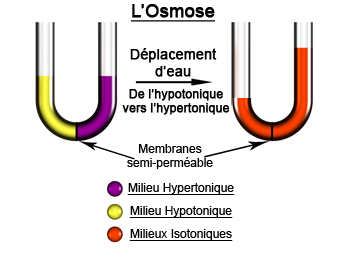
L’osmose est la force qui tend à équilibrer les concentrations moléculaires.
« osmose » est un mot créé en 1854 par le chimiste écossais Thomas Graham à partir du grec ὠσμός qui signifie « poussée ».
L'osmose est définie par sa mise en évidence expérimentale comme le phénomène de diffusion de molécules de solvant (l'eau de façon générale) à travers une membrane semi-perméable qui sépare deux liquides de concentrations en soluté différentes. Le passage de solvant d'un compartiment à l'autre va créer une différence de pression hydrostatique qui va compenser exactement la différence de pression osmotique (cf. ci-après).
Cette notion a permis de mieux comprendre le comportement des solutions aqueuses en chimie, à la fin du XIXe siècle ; mais elle est aussi particulièrement utile en physiologie et en biologie cellulaire pour expliquer les échanges chimiques au sein des organismes vivants.
Historique
En 1748 ou 1749, l'abbé Nollet remarque que lorsque l'on sépare de l'eau et de l'alcool par une vessie animale, l'eau passe dans l'alcool mais jamais l'inverse. Dans ses travaux sur les solutions aqueuses menés entre 1827 et 1832, René Dutrochet propose les termes « d'endosmose » et « d'exosmose » pour désigner ce phénomène. K. Vicrordt s'intéresse également à ce phénomène en 1848. En 1854, Thomas Graham travaille sur les substances colloïdes et découvre qu'elles ne peuvent pas passer à travers une membrane animale.
C'est M. Traube, en 1864, qui conçoit la première membrane artificielle en ferrocyanure de cuivre Cu2Fe(CN)6. En 1877, Wilhelm Friedrich Philipp Pfeffer (1845-1920) fait précipiter le ferrocyanure de cuivre dans un matériau poreux, ce qui permet d'avoir une membrane avec une bonne résistance mécanique.
En 1884, de Vries travaille sur la plasmolyse et la turgescence des cellules végétales.
En 1886, van 't Hoff publie une analogie entre les solutions aqueuses et les gaz parfaits et applique la thermodynamique à l'osmose. Il établit une loi similaire à la loi de Gay-Lussac et propose l'adjectif « semiperméable » pour désigner les membranes. Il reçoit le prix Nobel de chimie en 1901 pour ses travaux.
En 1899, A. Crum Brown utilise trois phases liquides (une solution aqueuse de nitrate de calcium saturée en phénol en bas, couche de phénol pur au milieu et une solution d'eau saturée en phénol en haut). Il remarque un phénomène d'osmose (l'eau passe de la phase du haut vers la phase du bas), la phase liquide du milieu jouant le rôle de membrane semiperméable. Il établit ainsi l'importance de la solubilité de l'espèce diffusante dans la membrane.
Entre 1901 et 1923, H. N. Morse et J. C. W. Frazer mènent un travail systématique de mesure de la perméabilité pour différents précipités gélatineux : des ferrocyanures et des phosphates d'uranyl, de fer, de zinc, de cadmium et de manganèse.
Potentiel chimique
Quand un soluté est dissout dans un solvant, le mélange désordonné des deux espèces produit un accroissement de l'entropie du système qui correspond à une réduction du potentiel chimique,(μ). Dans le cas d'une solution idéale la réduction du potentiel chimique est égale à :
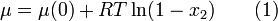
où R est la constante des gaz parfaits, T la température absolue et x2 la concentration du soluté en termes de fraction molaire. La plupart des solutions réelles s'approchent du comportement idéal aux faibles concentrations. Aux hautes concentrations les interactions entre solutés sont la cause d'un écart à l'Équation 1). Ce potentiel chimique réduit induit une force motrice qui est responsable de la diffusion de l'eau à travers la membrane semi-perméable. En effet un état d'équilibre entre les milieux sera atteint pour une égalité des potentiels chimiques.

















































