Tétroxyde d'osmium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Tétroxyde d'osmium | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Apparence | solide de formes variables, incolore à jaune pâle, d'odeur acre. | ||
| Propriétés chimiques | |||
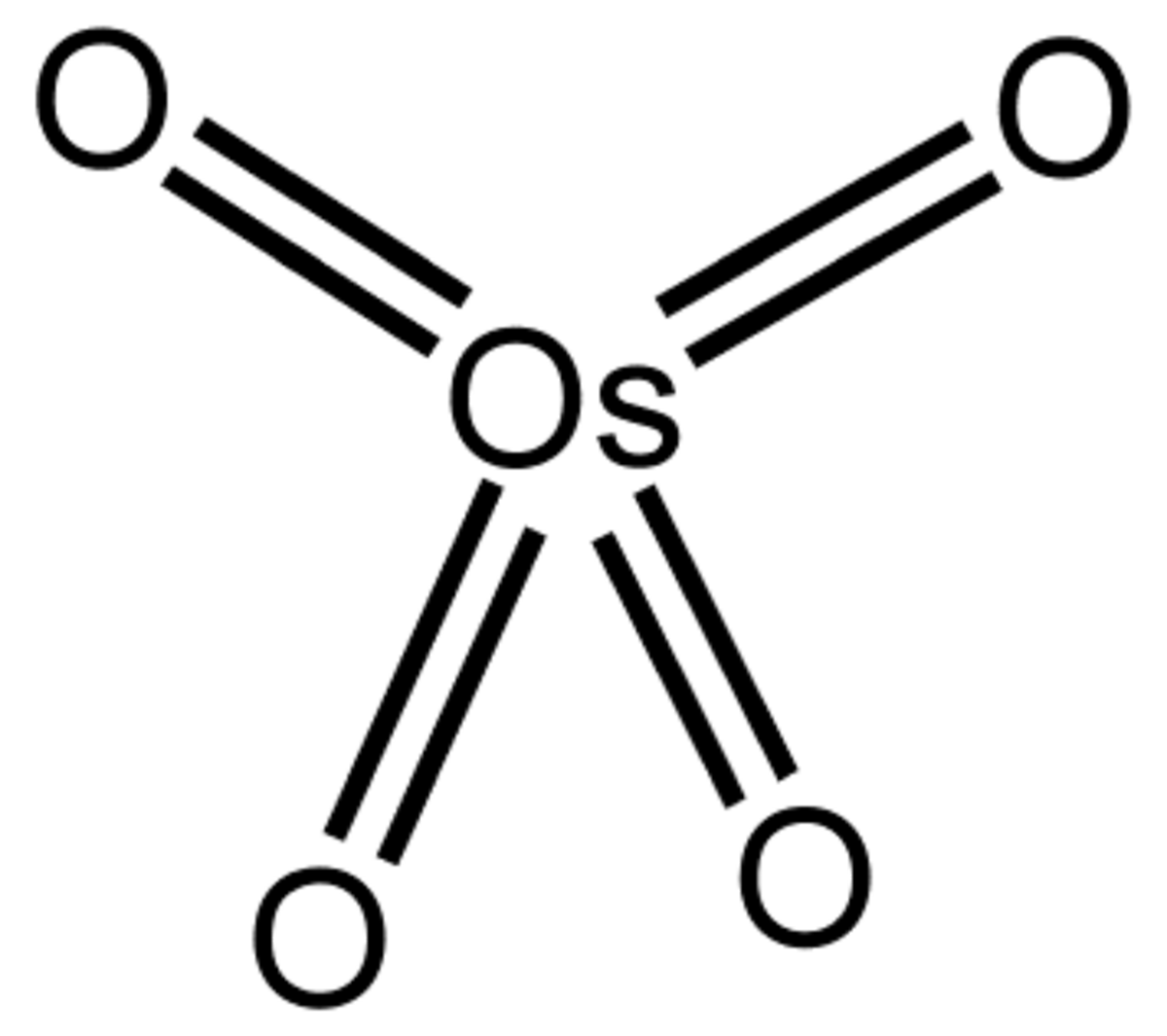
| Formule brute | OsO4 | ||
| Masse molaire | 254,23 ± 0,03 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 42 °C | ||
| T° ébullition | 130 °C | ||
| Solubilité | dans l'eau à 25 °C : 60 g·l-1 | ||
| Masse volumique | 4,9 g·cm-3 | ||
| Pression de vapeur saturante | à 27 °C : 1,5 kPa | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 26/27/28, 34, | |||
| Phrases S : (1/2), 7/9, 26, 45, | |||
| | |||
| |||
| | |||



| |||
| | |||


Danger | |||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,0019 ppm | ||
| | |||
Le composé chimique tétroxyde d'osmium (OsO4) est un oxyde de l'élément chimique osmium dans lequel ce dernier atteint son état d'oxydation le plus élevé : +8. Lorsque de l'osmium est exposé sous forme de poudre à l'air, il s'oxyde en tétroxyde d'osmium qui se sublime à température ambiante. Cela donne un gaz extrêmement toxique et à l'odeur particulière. En fait, ceci explique le nom de l'élément venant du grec osme qui signifie « odeur ».
Applications
L'oxyde est un puissant colorant souvent utilisé dans la microscopie électronique en transmission (MET) pour donner du contraste à l'image. De la même manière, il peut colorer la cornée humaine, ce qui entraîne la cécité, lorsque les précautions nécessaires ne sont pas observées.
En synthèse organique, il est parfois utilisé pour oxyder les alcènes en diols, à l'instar du permanganate de potassium, utilisé dilué et à froid. Il est notamment impliqué dans la réaction catalytique appelée dihydroxylation de Sharpless, du chimiste Karl Barry Sharpless, prix Nobel de chimie 2001.
En biologie cellulaire, le tétraoxyde d'osmium est également utilisé pour colorer les saccules de la partie cis de l'appareil de golgi.
Il est aussi utilisé en histologie comme fixateur.
Risques
Cet oxyde est extrêmement toxique, même en très faible quantité, et doit être manipulé avec d'importantes précautions. En particulier, l'inhalation même à des concentrations trop faibles pour en percevoir l'odeur peut entraîner des œdèmes aux poumons, et causer la mort. Des symptômes détectables peuvent n'apparaître que plusieurs heures après l'exposition.
Le 6 avril 2004, l'agence de presse américaine ABC News rapportait que les services secrets britanniques auraient déjoué une attaque terroriste impliquant une bombe au tétroxyde d'osmium.


















































