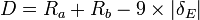Théorie VSEPR - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La théorie VSEPR (sigle de l'anglais Valence Shell Electronic Pairs Repulsion, en français RPECV : « répulsion des paires électroniques de la couche de valence ») est une méthode destinée à prédire la géométrie des molécules en se basant sur la théorie de la répulsion des électrons de la couche de valence. Elle est aussi connue sous le nom de « théorie de Gillespie » (ou théorie de Nyholm-Gillespie).
Origines
Ce sont les Britanniques N. Sigdwick et H. Powell qui les premiers ont émis cette idée, sur laquelle s'est fondé le chimiste canadien R.J Gillespie de l'université Mc Master Hamilton en Ontario, qui est le véritable instaurateur de cette théorie. La méthode VSEPR s'inscrit dans la poursuite des idées sur les liaisons chimiques de G.N Lewis (1916).
Notations
Dans la suite de cet article, et suivant les usages de la méthode VSEPR, on notera l'atome central de la molécule étudiée A.
Le nombre de doublets liants, c'est-à-dire le nombre de paires d'électrons liant l'atome central A aux autres atomes X de la molécule sera noté n.
N.B: En ce qui concerne la géométrie de la molécule une liaison multiple est assimilable à une liaison simple c'est-à-dire que n est plus simplement égal au nombre d'atomes liés à A.
Les doublets non liants, c'est-à-dire les paires d'électrons appartenant à l'atome central A et n'étant pas impliqués dans des liaisons seront notés E. Le nombre de doublets non liants sera noté m.
Les molécules simples, dont la géométrie est facilement définissable grâce à la méthode VSEPR sont donc de la forme : AXnEm
Prérequis et supposition
La méthode VSEPR est fondée sur un certain nombre de suppositions, notamment concernant la nature des liaisons entre atomes :
- Les atomes dans une molécule sont liés par des paires d'électrons.
- Deux atomes peuvent être liés par plus d'une paire d'électrons. On parle alors de liaisons multiples.
- Certains atomes peuvent aussi posséder des paires d'électrons qui ne sont pas impliqués dans une liaison. On parle de doublets non liants.
- Les électrons composant ces doublets liants ou non liants exercent les uns sur les autres des forces électriques répulsives. Les doublets sont donc disposés autour de chaque atome de façon à minimiser les valeurs de ces forces.
- Les doublets non liants occupent plus de place que les doublets liants.
- Les liaisons multiples prennent plus de place que les liaisons simples.
Améliorations du modèle
Longueur des liaisons
Jusqu'ici, nous avons considéré que les liaisons entre atomes étaient toutes de la même longueur, approximation grossière et bien éloignée de la réalité. En effet, les longueurs des liaisons varient en fonction des atomes impliqués et de la typologie de la liaison (liaison simple, liaison double, liaison triple, liaison aromatique…)
Il est possible de déterminer la distance séparant deux atomes de façon expérimentale, bien que celle-ci ne soit pas constante et dépende du milieu. On peut cependant définir une valeur moyenne.
Méthode avec les rayons de covalence
En première approximation, on pourra assimiler les atomes à des sphères dont le rayon est égal au rayon de covalence. La longueur d'une liaison sera alors donnée par la somme des rayons de covalence des atomes impliqués :
D = Ra + Rb Avec, Ra le rayon de covalence du premier atome, et Rb le rayon de covalence du second atome impliqué.
Méthode tenant compte de la différence d'électronégativité
Les atomes ayant chacun une électronégativité différente, cela influe aussi sur la longueur des liaisons, et plus particulièrement une forte différence d'électronégativité implique un raccourcissement important de la liaison. On peut donc établir la formule (empirique) suivante :
Avec Ra le rayon de covalence du premier atome (en picomètres), et Rb le rayon de covalence du second atome impliqué (en picomètres), δE la différence d'électronégativité entre les deux atomes (suivant l'échelle de Pauling).
Influence des liaisons multiples
Les formules ci-dessus permettent de calculer avec un taux d'erreur relativement faible les longueurs des liaisons simples. A partir de ces mesures, on peut facilement obtenir celles des liaisons multiples.
Une liaison double fait en moyenne, 86% de la longueur d'une liaison simple. Une liaison triple fait en moyenne, 78% de la longueur d'une liaison simple.
Les liaisons aromatiques telles que celles présentes dans la molécule de benzène, par exemple, sont intermédiaires entre des liaisons simples et des liaisons doubles :
Rayon de covalence du carbone: 77 pm Longueur d'une liaison carbone-carbone simple (calculée): 154 pm Longueur d'une liaison carbone-carbone double (calculée): 133 pm Longueur des liaisons carbone-carbone dans la molécule de benzène (expérimentales): 140 pm