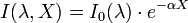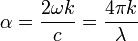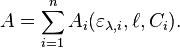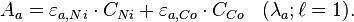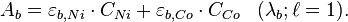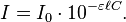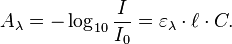Loi de Beer-Lambert - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La loi de Beer-Lambert, aussi connue comme la loi de Beer-Lambert-Bouguer et chez les francophones parfois même simplement comme la loi de Bouguer, est une relation empirique reliant l'absorption de la lumière aux propriétés des milieux qu'elle traverse.
La loi de Beer-Lambert établit une proportionnalité entre la concentration d'une entité chimique en solution, l'absorbance de celle-ci et la longueur du trajet parcouru par la lumière dans la solution. La loi de Beer-Lambert n'est cependant valable que sous certaines conditions : la lumière doit être monochromatique, la concentration des solutions doit être faible (de l’ordre de 10-4 mol.L-1), les solutions doivent être homogènes et le soluté ne doit pas réagir sous l’action de la lumière incidente.
Énoncé
Soit un rayonnement électromagnétique de longueur d'onde λ (par exemple lumière), traversant un milieu transparent. L'intensité de ce rayonnement subit une diminution exponentielle en fonction de la distance parcourue et de la densité des espèces absorbantes dans ce milieu.
- I est l'intensité de la lumière incidente.
- I est l'intensité de la lumière sortante.
- α est le coefficient d'absorption (en m-1 ou en cm-1).
- X est la longueur du trajet optique (en m ou en cm).
La valeur du coefficient d'absorption α varie entre différents matériaux et aussi avec la longueur d'onde pour un matériau particulier. Elle est définie par l'équation :
- ω est la pulsation angulaire du rayonnement électromagnétique.
- k est le coefficient d'extinction linéique, il exprime l'atténuation de l'énergie du rayonnement électromagnétique à travers le milieu.
- c est la célérité du rayonnement électromagnétique dans le vide.
Additivité
À une longueur d'onde donnée λ, l'absorbance A d'un mélange de n espèces absorbantes est la somme des absorbances individuelles :
Exemple d'application
Soit une solution contenant un mélange de Ni(II) et de Co(II), on cherche à déterminer leurs concentrations respectives C et C en appliquant la loi de Beer-Lambert.
Pour cela, on mesure l'absorbance de la solution à deux longueurs d'onde différentes λ = 393 nm et λ = 510 nm qui correspondent respectivement aux absorbances maximales des deux entités en solution prises chacune à part. On établit alors les équations suivantes :
Connaissant A et ε dans chaque cas, on peut déterminer les concentrations relatives de chaque espèce par simple résolution de ce système d'équations.
N.B. : contrairement aux absorbances, les transmittances de plusieurs entités ne sont pas des grandeurs additives.
Dérivation
L'absorption d'un faisceau lumineux monochromatique dans un milieu homogène et isotrope est proportionnelle à la longueur du trajet optique suivi par cette radiation et la concentration, en solution, ou la pression partielle, en phase gazeuse, des espèces absorbantes.
La loi de Beer-Lambert peut s'exprimer ainsi :
Ou encore :
- I / I0 est la transmittance de la solution (sans unité).
- A est l’absorbance ou densité optique à une longueur d'onde λ (sans unité).
- ε est l'absorptivité molaire (aussi appelé coefficient d'extinction molaire), exprimée en L·mol−1·cm−1. Elle dépend de la longueur d'onde, la nature chimique de l'entité et la température.
- ℓ est la longueur du trajet optique dans la solution traversée, elle correspond à l'épaisseur de la cuve utilisée (en cm).
- C est la concentration molaire de la solution (en mol.L−1). Dans le cas d'un gaz, C peut être exprimée comme une densité (unités de longueur réciproque au cube, cm−3).
Cette équation est très utile pour la chimie analytique. En effet, si ℓ et ε sont connus, la concentration d'une substance peut être déduite de la quantité de lumière transmise par elle.