Acétylacétone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acétylacétone | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | diacétylméthane β,δ-dioxopentane AcAc | |
| No CAS | ||
| No EINECS | ||
| SMILES | ||
| Apparence | liquide incolore, d'odeur caractéristique | |
| Propriétés chimiques | ||
| Formule brute | C5H8O2 | |
| Masse molaire | 100,1158 ± 0,0052 g·mol-1 | |
| Moment dipolaire | 2,78 D | |
| Diamètre moléculaire | 0,564 nm | |
| Propriétés physiques | ||
| T° fusion | -23 °C | |
| T° ébullition | 140 °C | |
| Solubilité | dans l'eau : 160 g·l-1 | |
| Masse volumique | (eau = 1) : 0.98 | |
| T° d’auto-inflammation | 340 °C | |
| Point d’éclair | 34 °C | |
| Limites d’explosivité dans l’air | 2,4–11,6 %vol | |
| Pression de vapeur saturante | à 20 °C : 0,93 kPa | |
| Thermochimie | ||
| Cp | ||
| Propriétés optiques | ||
| Indice de réfraction |
| |
| Précautions | ||
| | ||
| ||
| Phrases R : 10, 22, | ||
| Phrases S : (2), 21, 23, 24/25, | ||
| | ||
|
3 2 0 | ||
| Stockage | Catégorie 4 (stocker entre +15 °C et +25 °C) | |
| | ||


Attention | ||
| Écotoxicologie | ||
| DL | 790 mg·kg-1 (voie dermale) 575 mg·kg-1 (voie orale) | |
| | ||
L'acétylacétone est un composé organique de formule chimique C5H8O2. Cette dicétone nommée selon la nomenclature IUPAC : pentane-2,4-dione, bien que cette dénomination puisse être soumise à délibération (voir ci-après), puisqu'elle ne décrit pas exactement la structure du composé.
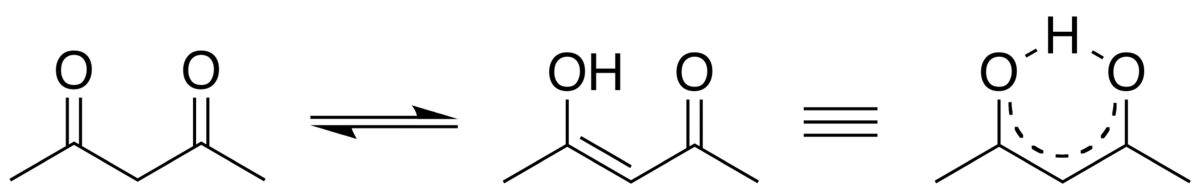
Propriétés
Les formes tautomères énol et cétone de l'acétylacétone coexistent en solution, comme montré figure 1. La symétrie C2v de la forme énol (forme à droite pour l'équilibre décrit figure 1) a été observée via différentes méthodes incluant la spectroscopie micro-ondes. La liaison hydrogène de l'énol réduit la répulsion stérique entre les deux groupes carbonyles. La constante d'équilibre K entre les deux formes tautomères est de 11,3 en phase gazeuse. Cette constante tend à croître dans les solvants apolaires : dans le cyclohexane : 42; dans le toluène : 10; dans le THF : 7,2; diméthylsulfoxyde : 2; et dans l'eau : 0,23.
Ion acétylacétonate
L'« ion acétylacétonate » C5H7O2− est la base conjuguée du pentane-2,4-dione. En réalité, l'ion libre n'existe pas en solution, mais est lié à un cation comme Na+. En pratique, l'existence de l'anion libre, communément abrévié en acac−, est un modèle utile.
Préparation
Deux procédés classiques sont utilisés pour synthétiser l'acétylacétone. Dans le premier, l'acétone et l'anhydride acétique réagissent grâce à l'addition de BF3 utilisé comme catalyseur.
- (CH3CO)2O + CH3C(O)CH3 → CH3C(O)CH2C(O)CH3
Le second procédé implique la condensation catalysée par base de l'acétone et de l'acétate d'éthyle, suivie par une acidification :
- NaOEt + EtO2CCH3 + CH3C(O)CH3 → NaCH3C(O)CHC(O)CH3 + 2 EtOH
- NaCH3C(O)CHC(O)CH3 + HCl → CH3C(O)CH2C(O)CH3 + NaCl
En raison de la facilité de procéder à ces synthèses, de nombreux analogues des acétylacétonates sont connus. On peut ainsi citer : C6H5C(O)CH2C(O)C6H5 (dbaH) et (CH3)3CC(O)CH2C(O)CC(CH3)3. L'hexafluoroacétylacétonate est très largement utilisé, en particulier pour générer des complexes de métaux volatiles.