Anhydride acétique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Anhydride acétique | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, tres mobile, d'odeur âcre. | ||
| Propriétés chimiques | |||
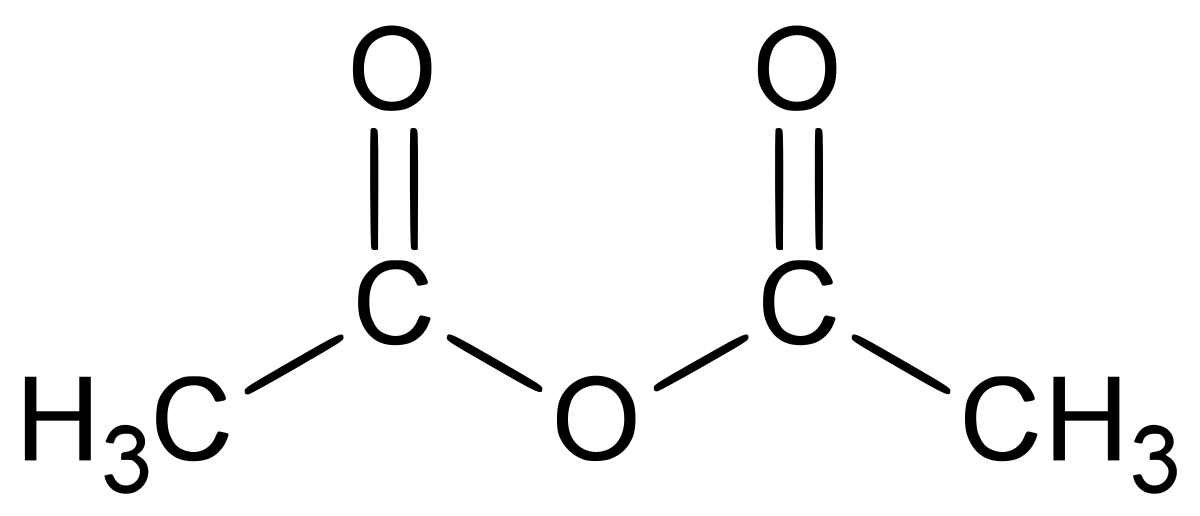
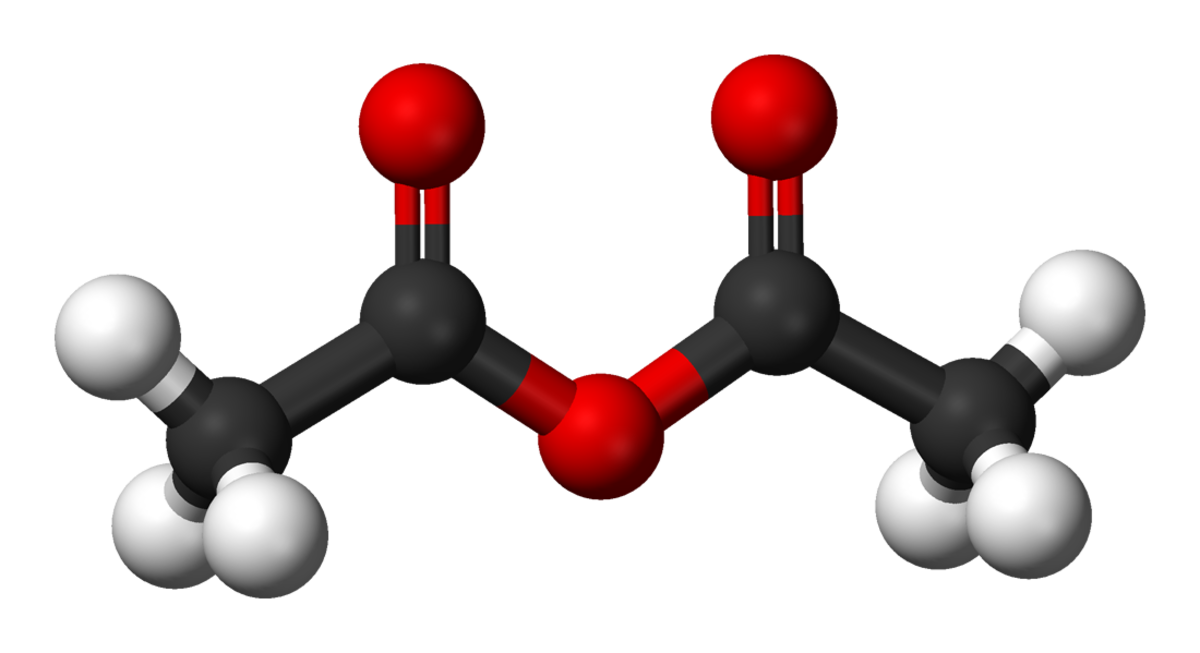
| Formule brute | C4H6O3 | ||
| Masse molaire | 102,0886 ± 0,0045 g·mol-1 | ||
| Moment dipolaire | ≈2,8 D | ||
| Diamètre moléculaire | 0,554 nm | ||
| Propriétés physiques | |||
| T° fusion | -73 °C | ||
| T° ébullition | 139 °C | ||
| Solubilité | 120 g·l-1 (eau, 20 °C), soluble dans l'éthanol l'acétone, le chloroforme, l'éther diéthylique, l'acétate d'éthyle et le DMSO | ||
| Masse volumique | 1,08 g·cm-3 | ||
| T° d’auto-inflammation | 316 °C | ||
| Point d’éclair | 49 °C (coupelle fermée) | ||
| Limites d’explosivité dans l’air | 2,7–10,3 %vol | ||
| Pression de vapeur saturante | 5 hPa (20 °C) | ||
| Point critique | 46,8 bar, 295,85 °C | ||
| Thermochimie | |||
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 10, 20/22, 34, | |||
| Phrases S : (1/2), 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
2 3 1 | |||
| | |||



| |||
| | |||


Danger | |||
| Écotoxicologie | |||
| DL | 1 780 mg·kg-1 (rat, oral) | ||
| CL | 1 000 ppm/4H (rat, inhalation) | ||
| Seuil de l’odorat | bas : 0,12 ppm haut : 0,36 ppm | ||
| Composés apparentés | |||
| Autres composés | acide acétique | ||
| | |||
L'anhydride acétique ou anhydride éthanoïque est l'anhydride de l'acide acétique; il est obtenu en liant deux molécules d'acide acétique par condensation avec élimination d'eau (d'où le nom d'anhydride).
L'anhydride acétique dégage des vapeurs irritantes pour les muqueuses oculaires et respiratoires. Ses effets sur le corps humain sont principalement des brûlures cutanées dues à un contact avec la peau et des effets lacrymogènes dus aux gaz volatiles. Il faut donc le manipuler avec du matériel de protection et sous une hotte qui aspire les gaz dangereux. Il s'hydrolyse facilement avec l'humidité de l'air et est inflammable.
Rôle dans la synthèse de l'aspirine
L'anhydride acétique est utilisé pour faire la synthèse de l'acide acétylsalicylique, plus connu sous le nom d'aspirine en réagissant avec l'acide salicylique. Cette réaction est lente et incomplète.




















































