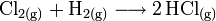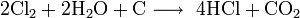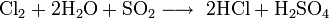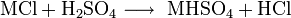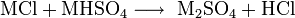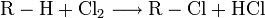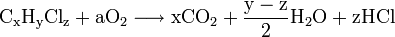Acide chlorhydrique - Définition
La liste des auteurs de cet article est disponible ici.
Histoire
L'acide chlorhydrique a été découvert au voisinage de l'an 800 par l'alchimiste arabo-yéménite Jabir Ibn Hayyan, qui l'obtint en mélangeant du sel (chlorure de sodium, NaCl) et du vitriol (acide sulfurique, H2SO4) en solution. Jabir découvrit et inventa un grand nombre de produits chimiques, et relata ses découvertes dans plus de vingt ouvrages qui permirent la propagation de ses connaissances sur l'acide chlorhydrique et d'autres produits chimiques pendant plusieurs siècles. Son invention de l'eau régale, mélange d'acide chlorhydrique et d'acide nitrique permettant de dissoudre l'or, participa à la quête de la pierre philosophale.
Au Moyen Âge, les alchimistes européens connaissaient l'acide chlorhydrique sous le nom d'esprit de sel ou acidum salis. La vapeur, le chlorure d'hydrogène, était appelée gaz acide marin. L'ancien nom acide muriatique possède la même origine (muriatique signifie "appartenant au sel ou à l'eau de mer"), et le nom est parfois encore utilisé. Basilius Valentinus, l'abbé-alchimiste de l'abbaye d'Erfurt (Allemagne), en produisit une quantité importante au XVe siècle.
Au XVIIe siècle, Johann Rudolf Glauber de Karlstadt am Main (Allemagne) utilisa du sel (NaCl) et de l’acide sulfurique pour préparer du sulfate de sodium (Na2SO4), produisant ainsi du chlorure d’hydrogène gazeux (HCl). Joseph Priestley de Leeds prépara du chlorure d’hydrogène pur en 1772, et en 1818 Humphry Davy de Penzance (Royaume-Uni) démontra que ce produit chimique est constitué d'hydrogène et de chlore.
Au cours de la révolution industrielle, la demande de substances alcalines, et notamment de carbonate de sodium, augmenta fortement en Europe, et le procédé industriel mis au point par Nicolas Leblanc permettait une production bon marché à grande échelle en tant que produit secondaire. Dans le procédé Leblanc, du sel est transformé en carbonate de sodium, en utilisant comme réactifs de l’acide sulfurique, de la craie et du charbon, avec également une production secondaire de chlorure d'hydrogène gazeux. Jusqu'à ce que la promulgation en 1863 de l'Alkali Act l'interdise au Royaume-Uni, le chlorure d'hydrogène était relâché dans l'air. À la suite de cette interdiction, les producteurs de carbonate de sodium furent contraints de dissoudre le gaz dans l'eau, produisant ainsi de l'acide chlorhydrique à l'échelle industrielle.
Lorsque le procédé Leblanc fut remplacé au début du XXe siècle par le procédé Solvay, sans production secondaire d'acide chlorhydrique, celui-ci s'était d'ores et déjà imposé comme un réactif chimique important pour un grand nombre d'applications. Son intérêt commercial contribua à l'émergence d'autres techniques de production, qui sont toujours utilisées à l'heure actuelle (voir dans la suite).
L'acide chlorhydrique est cité comme un précurseur dans la Table 2 de la convention de 1988 contre le trafic de drogues, du fait de son utilisation dans la synthèse d'héroïne et de cocaïne.
Production
Réaction entre chlore et hydrogène
Le dichlore gazeux réagit avec le dihydrogène pour produire du chlorure d'hydrogène gazeux. Ce dernier est ensuite absorbé dans l'eau.
La réaction a lieu dans un brûleur: les 2 gaz sont acheminés dans une chambre de combustion où ils réagissent en présence d'une flamme qui permet une température supérieure à 2 000 °C. L'absence d'humidité dans les réactifs est primordiale, car la vapeur d'eau permet au chlorure d'hydrogène formé de corroder l'installation. Pour éviter cette corrosion, une installation en silice ou en graphite est nécessaire. Le mélange hydrogène et chlore étant explosif, il faut s'assurer que la réaction est complète. Pour ce faire un léger excès d'hydrogène (1-2%) est utilisé, ce qui assure un produit exempt de toute trace de chlore.
D'autres procédés basés sur le même principe "brûlent" du carbone (coke) ou du dioxyde de soufre en présence de chlore et de vapeur d'eau.
Réaction entre chlorures et acide sulfurique
Cette voie de synthèse appelée aussi procédé au sulfate est un grand consommateur d'énergie et son importance diminue actuellement dans la production du chlorure d'hydrogène. L'acide sulfurique réagit en 2 étapes avec le sel contenant le chlorure:
La première réaction a lieu à 150 à 300 °C, alors que la deuxième étape nécessite une température d'environ 550 à 600 °C et un excès de sel.
Le procédé Mannheim et le procédé Berlin sont 2 exemples de production utilisant cette voie de synthèse.
Coproduit de la chloration et de la fluoration
La majeure partie de la production d'acide chlorhydrique est liée à la chloration de composés organiques notamment la production de chlorure de vinyle à partir de 1,2-dichloroéthane. Il s'agit souvent d'une production intégrée, c.-à-d. que le flux gazeux de chlorure d'hydrogène quitte l'installation de chloration pour être utilisé dans une autre installation chimique. Il s'agit d'une réaction de substitution d'un atome d'hydrogène par un atome de chlore provenant du dichlore. L'atome d'hydrogène ainsi libéré se recombine pour former le chlorure d'hydrogène.
La récupération de de l'acide s'effectue par condensation des composés chlorés, par distillation fractionnée des produits issus de la chloration après liquéfaction ou par absorption dans l'eau du chlorure d'hydrogène.
Une voie de synthèse de la fluoration permet la production de d'acide chlorhydrique. La réaction est semblable à la chloration, mais cette fois c'est un atome de chlore préalablement fixé sur le substrat qui est substitué par un atome de fluor. Cette réaction est notamment utilisé pour la fluoration de chlorofluoroalcanes, de composés aromatiques et d'hétérocycles.
L'utilisation de catalyseurs est souvent nécessaire pour les cas de multifluoration: les halogénures d'antimoine sont les plus usités en phase liquide alors qu'en phase gazeuse ce sont les sels de fluor tels le fluorure d'aluminium ou le fluorure de chrome.
Le chlorure d'hydrogène gazeux obtenu est soit réutilisé directement, soit dissous dans de l'eau pour former de l'acide chlorhydrique.
Incinération de déchets chlorés
Les composés organiques chlorés correspondent à une classe de déchets toxiques notamment liés à une faible biodégradabilité. L'incinération est la méthode la plus utilisée pour neutraliser de telles substances. La combustion a lieu à des températures supérieures à 1 000 °C dans des installations réfractaires en présence d'excès d'oxygène. Les gaz de combustion contenant de l'eau, du gaz carbonique et du chlorure d'hydrogène sont refroidis via un refroidissement à l'eau par contact direct. L'acide est récupéré par absorption dans l'eau.
Marché industriel
L'acide chlorhydrique est produit en solution jusqu'à des concentrations de 38 % HCl. Des concentrations plus élevées sont possibles d'un point de vue chimique, mais l'évaporation est alors importante et tant le stockage que la manipulation demandent des précautions supplémentaires, telles des températures basses ou une mise sous pression. Les solutions produites pour l'industrie ont donc des concentrations voisines de 30 % à 34 % HCl, optimisées pour le transport de manière à limiter les pertes par évaporation. Les solutions pour un usage domestique (principalement dans les produits d'entretien) ont généralement des concentrations de l'ordre de 10 % à 12 % HCl, pour lesquelles il est toutefois recommandé de diluer de nouveau avant utilisation.
Les principaux fabricants d'acide chlorhydrique dans le monde sont notamment Dow Chemical avec 2 millions de tonnes par an, ainsi que Formosa plastics, Georgia gulf corporation, Tosoh corporation, Akzo Nobel et Tessenderlo avec des productions comprises entre 0,5 et 1,5 millions de tonnes par an. La production mondiale totale est estimée à 20 millions de tonnes par an, dont environ 3 millions de tonnes par synthèse directe et le complément comme produit secondaire de réactions organiques. La plus grande partie de la production est utilisée directement par le producteur : le marché mondial « externe » est estimé à 5 millions de tonnes par an.