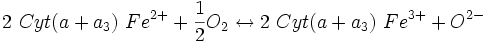Chaîne respiratoire - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
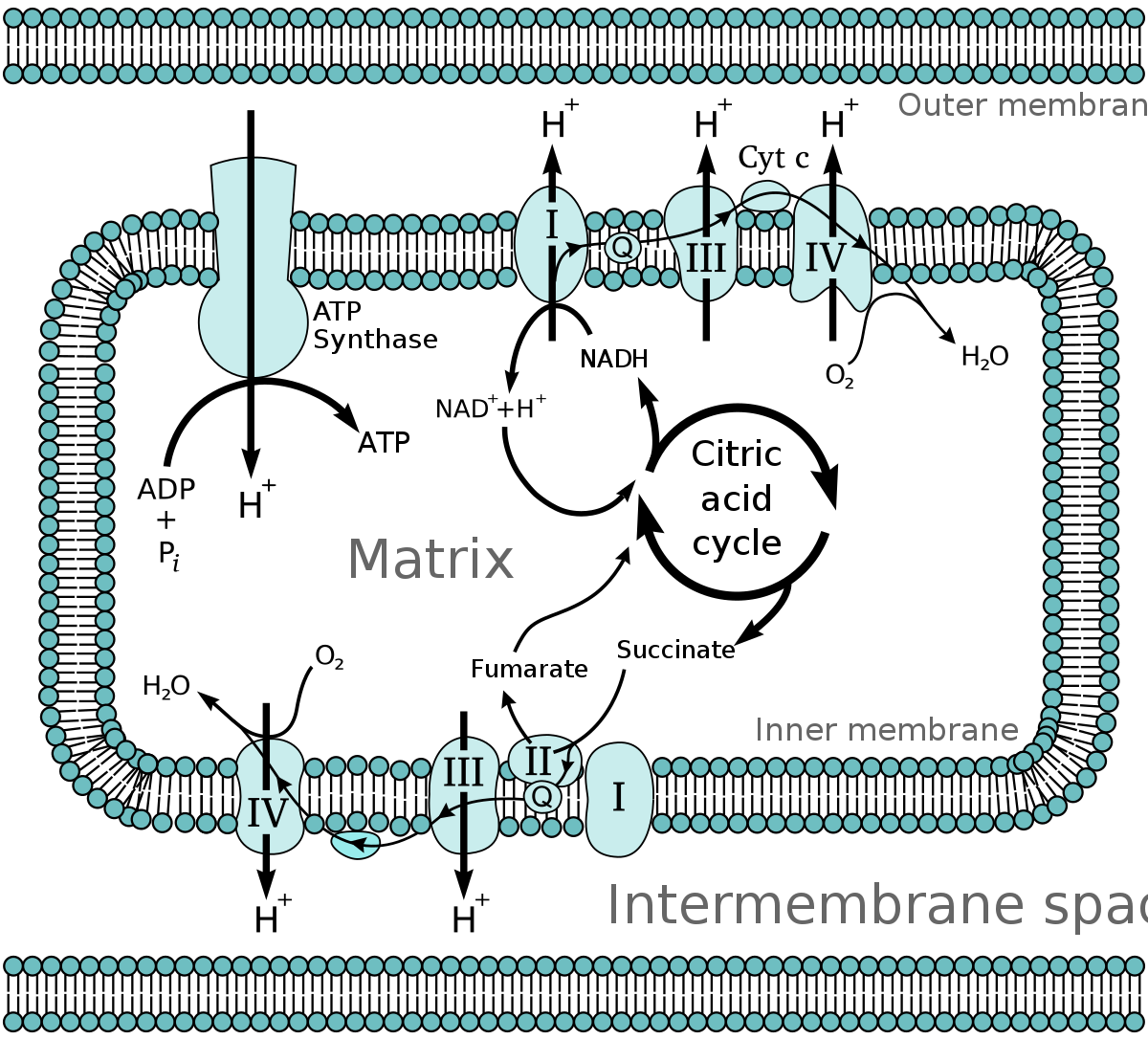
La chaîne respiratoire est constituée d'un ensemble complexe de protéines membranaires de la mitochondrie des cellules eucaryotes qui servent à réoxyder les coenzymes NADH et ubiquinone (CoQ) qui ont été réduits en particulier au cours du cycle de Krebs. Cette réoxydation s'accompagne de la création d'un gradient transmembranaire de protons. Ce gradient est une forme de stockage de l'énergie contenue dans les coenzymes, qui dérive elle-même de l'énergie contenue dans les molécules dégradées au cours du catabolisme. Le gradient de proton va servir à fabriquer de l'ATP, molécule énergétique universellement utilisable, au niveau de l'ATP synthase, une protéine membranaire mitochondriale. Ce mécanisme de phosphorylation oxydative a été découvert par Peter Mitchell, ce qui lui a valu le prix Nobel de chimie en 1978. Ce mécanisme est aussi connu sous le nom de Théorie chimiosmotique (de Mitchell). Additionné à la synthèse d'ATP par les ATP synthase on la nomme phosphorylation oxydative.
Origine des réactifs de la chaîne respiratoire
Lors des réactions du catabolisme que sont la glycolyse (dans le cytosol) et le cycle de Krebs (dans la mitochondrie) il y a production de coenzymes réduits (NADH et CoQH2). Ces coenzymes vont êtres réoxydés par la chaîne respiratoire (en aérobiose) au niveau des crêtes de la membrane interne mitochondriale ou dans la membrane plasmique des bactéries.
Inhibiteurs de la chaîne respiratoire
Ces inhibiteurs sont des poisons qui ont été utilisés pour identifier les intermédiaires de la chaîne respiratoire. En effet, ils ont permis d'élucider le mécanisme de fonctionnement de la chaîne respiratoire puisque leur action est très spécifique. Citons par complexe :
- I - Les barbituriques, la roténone, l'amytal, la ptéricidine.
- II - Les malonates.
- III - Les antimycines A.
- IV - Le cyanure, le cobalt, les azotures, monoxyde de carbone.
- V - Le dicyclohexylcarbodiimide (DCCD), l'oligomycine, l'atractyloside.
Enchaînement des systèmes d'oxydoréduction de la chaîne respiratoire
- Remarque
- L'enchaînement indiqué ici concerne les organismes eucaryotes, la chaîne respiratoire au niveau de la mitochondrie.
L'ordre dans lequel on trouve les éléments de la chaîne respiratoire (figure 1) dépend de leur potentiel standard d'oxydoréduction (tableau 1).
| Systèmes rédox | Potentiel standard (à pH = 7 et 25 °C) |
|---|---|
| NAD+/NADH | -0,32 V |
| FP/FPH2 | -0,14 V |
| CoQ/CoQH2 | -0,09 V |
| Cytb Fe3+/Cytb Fe2+ | +0,04 V |
| CytC1 Fe3+/CytC1 Fe2+ | +0,22 V |
| CytC Fe3+/CytC Fe2+ | +0,26 V |
| Cyt(a+a3) Fe3+/Cyt(a+a3) Fe2+ | +0,29 V |
| ½O2/O2- | +0,82 V |
La réaction de synthèse d'ATP :
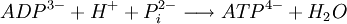
Est une réaction endergonique, elle a besoin d'énergie pour avoir lieu. Sa variation d'enthalpie libre standard (ΔG°) est égale à + 30 kJ/mol.
Lors de la chaîne respiratoire, trois réactions libèrent suffisamment d'énergie (variation d'enthalpie libre standard (ΔG°) est inférieure ou égale à - 30 kJ/mol) :
-
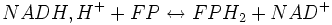
-
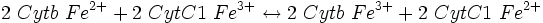
-