Glycolyse - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La glycolyse (γλῠκὖς glykýs « sucré » et λύσις lýsis « dissolution ») ou voie d'Embden-Meyerhof-Parnas est une voie métabolique d'assimilation du glucose et de production d'énergie. Elle se déroule dans le cytoplasme (ou cytosol) de la cellule. Comme son nom l'indique elle nécessite du glucose et a pour produit du pyruvate. Ce dernier peut soit entrer dans le cycle de Krebs, qui se déroule dans la mitochondrie des eucaryotes ou le cytoplasme des bactéries en aérobiose, soit être métabolisé par fermentation en anaérobiose, pour produire par exemple du lactate ou de l'éthanol.
Principe général
La glycolyse est un mécanisme de régénération de l'ATP qui ne nécessite pas d'oxygène. Au cours de ce processus, on assiste à :
- des réactions d'oxydo-réduction au cours desquelles un accepteur d'électrons (coenzyme NAD) est réduit :
-
- NAD+ + 2 H+ + 2 e− → (NADH,H+)
- des synthèses d'ATP par phosphorylation de l'ADP (formation de 4 molécules d'ATP, mais consommation de 2, soit au total formation de 2 molécules d'ATP) : 2 ADP + 2 Pi + 2 H+ → 2 ATP + 2 H2O. Le symbole Pi représente ici le phosphate inorganique HPO42- (ou hydrogénophosphate).
La glycolyse se traduisant par la réduction de coenzymes, elle s'accompagne donc de l'oxydation de molécules organiques. On peut dire qu'elle correspond à l'oxydation du glucose en pyruvate :
-
- C6H12O6 + 2 NAD+ → 2 CH3-CO-COOH + 2 (NADH,H+)
couplée à
-
- 2 ADP + 2 Pi + 2 H+ → 2 ATP + 2 H2O
soit au total
-
- glucose + 2 ADP + 2 Pi + 2 H+ + 2 NAD+ → 2 pyruvate* + 2 ATP + 2 (NADH,H+) + 2 H2O
*Le terme « pyruvate » (CH3-CO-COO-) désigne en toute rigueur son acide conjugué (l'acide pyruvique CH3-CO-COOH).
Isomérisation du glucose-6-phosphate
Il s'agit d'une isomérisation, réaction réversible catalysée par une phosphohexose isomérase donnant, à partir de glucose-6-phosphate du fructose-6-phosphate.
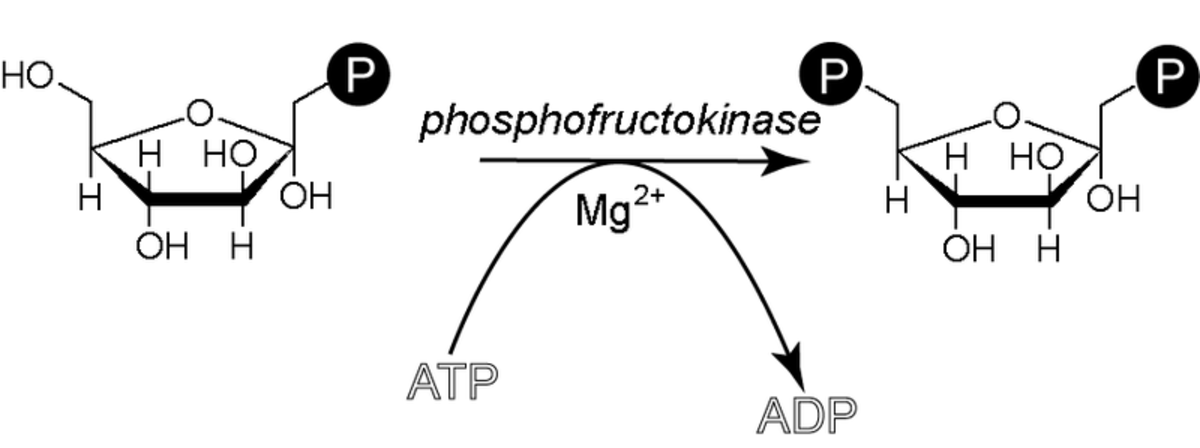
Synthèse de fructose-1,6-biphosphate
Cette réaction, catalysée par une phosphofructokinase (PFK) est irréversible et Mg2+ dépendante. Cette enzyme catalyse la première étape qui soit spécifique de la glycolyse. Elle est très fortement régulée de manière allostérique par l'ATPlibre (l'ATPlibre est la forme de l'ATP non complexé au magnésium), qui est le produit final "utile" de la glycolyse. Plus la concentration en ATPlibre est importante, plus cette réaction est lente et, inversement, plus la concentration en ATPlibre est faible, plus l'enzyme est active. Il s'agit d'un système cybernétique d'autocontrôle de la glycolyse. Plusieurs modéles mathématiques de la glycolyse ont été mis au point et montrent que cette étape est la plus importante de celles qui contrôlent le flux de la glycolyse.
L'inhibition par l'ATP est réversible par l'AMP, ce qui permet de garder un rapport ATP/AMP constant.
Mais elle est surtout régulée par le fructose-2,6-biphosphate (F26BP): En effet, la production de F2,6BP à partir du F6P a pour seule fonction de mettre en évidence une saturation de la voie en F6P ("trop plein"), car le F26BP n'a pas de devenir métabolique. Par allostérie, le F26BP active donc la phosphofructokinase afin de stimuler la consommation de F6P et ainsi empêcher sa propre formation.
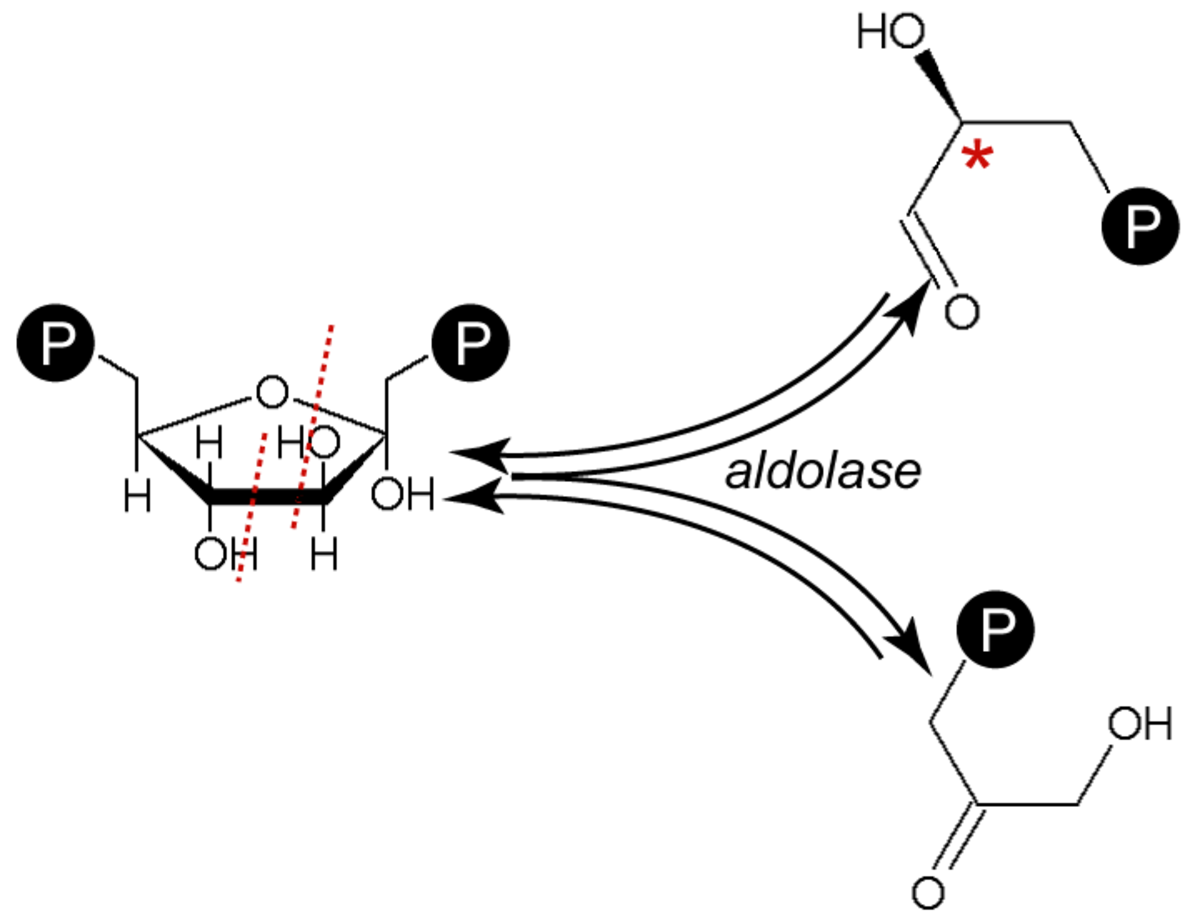
Formation des trioses phosphates
Formation du glycéraldéhyde-3-phosphate (3-PGA) et du dihydroxyacétonephosphate (PDHA)
Cette réaction est réversible et catalysée par une aldolase (groupe des lyases). (Le dihydroxyacétonephosphate est la molécule du bas). Il est possible de passer, de manière réversible, du D-glycéraldéhyde-3-phosphate (3-PGA) au dihydroxyacétonephosphate (PDHA) grâce à la triose-phosphateisomérase. C'est la réaction inverse de la condensation aldolique.
Isomérisation des triosephosphates
Cette réaction est réversible (catalysée par une triosephosphateisomérase) mais la réaction suivante consommant du D-glycéraldéhyde-3-phosphate, l'équilibre est déplacé dans le sens de la synthèse de ce dernier. (Dans les images suivantes, le symbole P encerclé représente un groupement -PO32-).
Récupération de l'énergie
Synthèse du 1,3-diphosphoglycérate
Cette réaction d'oxydoréduction, réversible et catalysée par une D-glycéraldéhyde-3-phosphate déshydrogénase (oxydo-réductase), conduit à la formation d'une liaison acylthioester à haut potentiel de transfert. Cette étape constitue le début de la seconde partie de la glycolyse. L'énergie contenue dans les liaisons à haut potentiel de transfert va être utilisé pour la synthèse de l'ATP. Les coenzymes sont réduits (gain d'électrons).
Dans l'érythrocyte, une réaction catalysée par une mutase produit du 2,3-diphosphoglycérate à partir du 1,3-diphosphoglycérate, un important effecteur allostérique de l'hémoglobine (régulation de son affinité pour l'oxygène). Le 2,3-diphosphoglycérate est ensuite converti en 3-phosphoglycérate sans production d'une molécule d'ATP (relargage d'un phosphate inorganique) par la 2,3-diphosphoglycérate phosphatase, lequel suit la voie de la glycolyse.
Synthèse de 3-phosphoglycérate et récupération d'ATP
Il y a synthèse d'ATP (récupération d'énergie), cette réaction, réversible, est catalysée par une phosphoglycératekinase (transférase).
Synthèse du 2-phosphoglycérate
Cette réaction, réversible, est catalysée par une phosphoglycératemutase (groupe des transférases) .
Synthèse du phosphoénolpyruvate
Cette réaction, catalysée par une énolase (groupe des lyases), réversible, conduit à la formation d'une liaison à haut potentiel de transfert (fonction énolphosphate), le phosphoénolpyruvate (PEP) au ΔG° = 51 kJ.mol−1.
Synthèse de pyruvate et récupération d'ATP
Le groupement phosphate et sa liaison à haut potentiel de transfert permettent par couplage la synthèse d'une molécule d'ATP. Cette réaction, Mg2+ dépendante et irréversible, est catalysée par une pyruvatekinase.