Chimie supramoléculaire - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
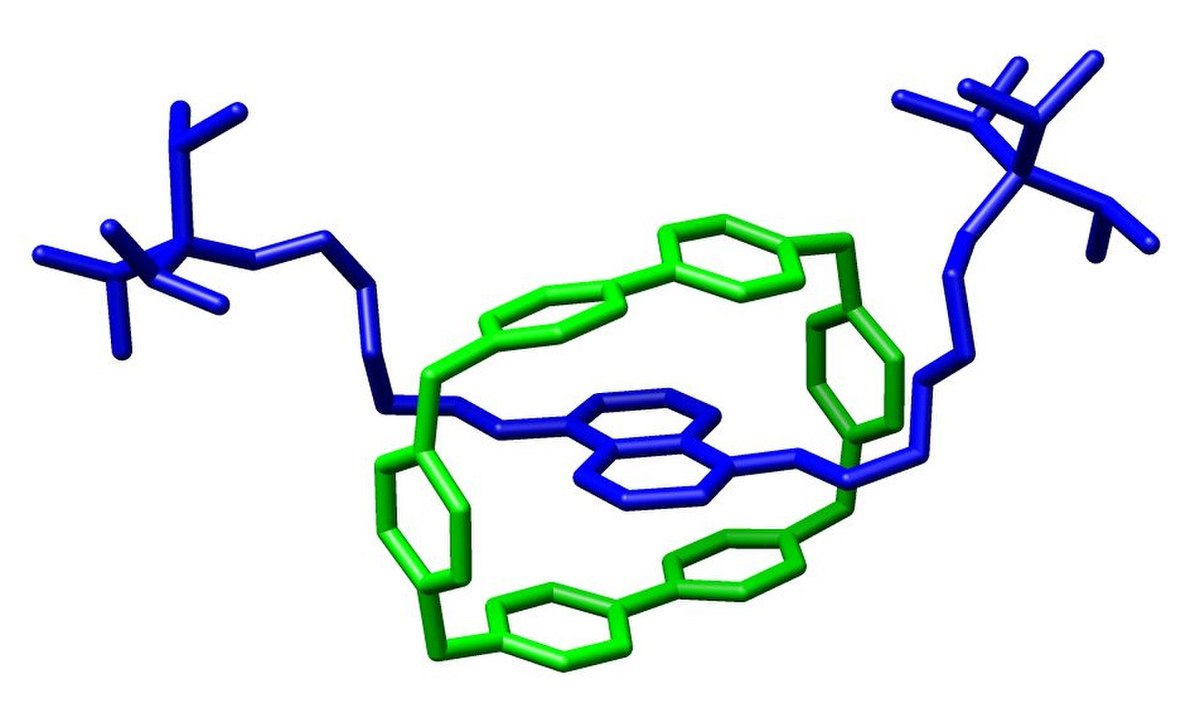
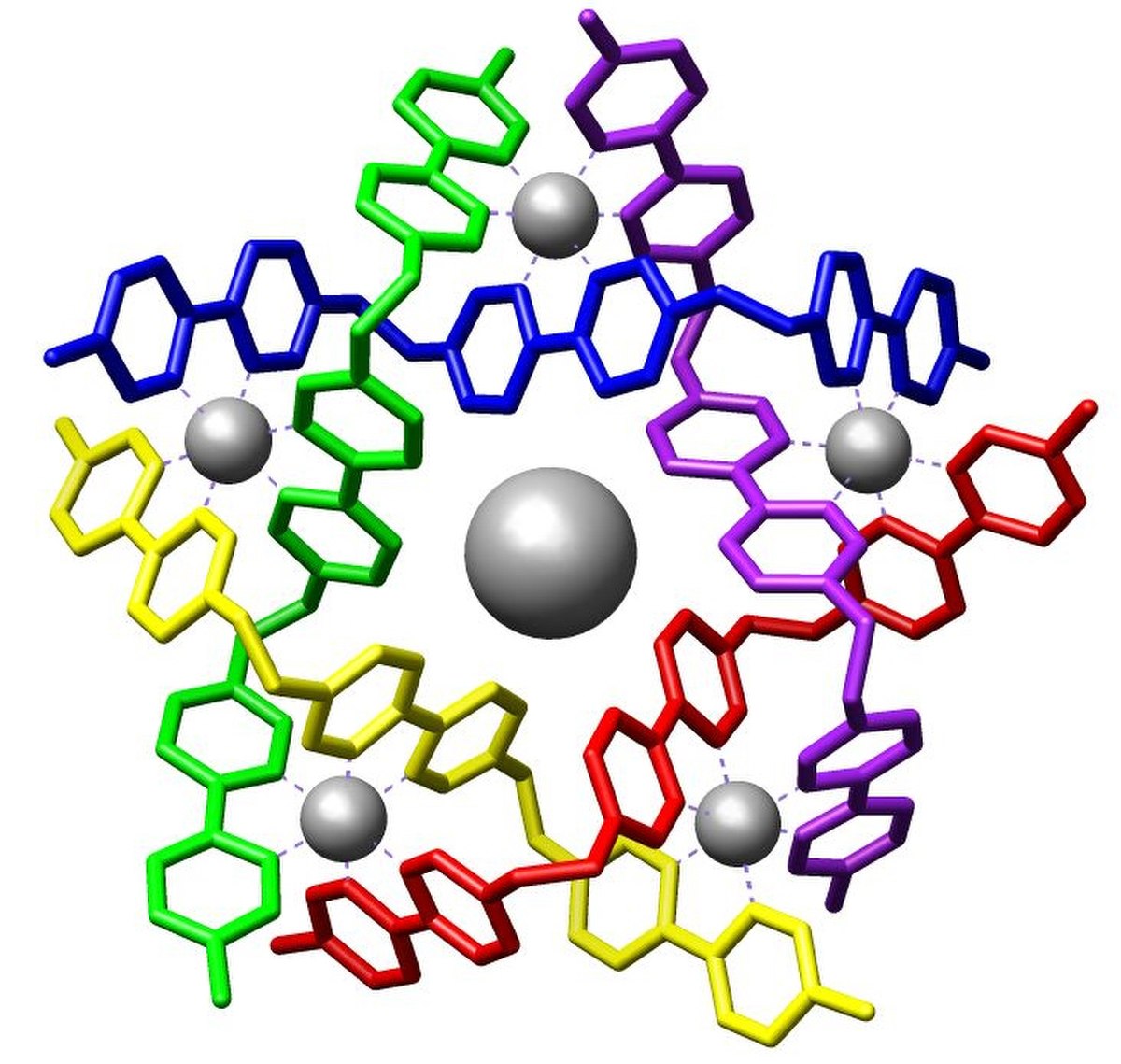
La chimie supramoléculaire est une branche de la chimie qui repose sur les interactions non-covalentes ou faibles entre atomes au sein d'une même molécule ou entre molécules elles-mêmes, au sein d'un ensemble moléculaire. Son objectif est de comprendre ou de construire des édifices de taille nanométrique. Le principe est d'utiliser des briques moléculaires, qui une fois mélangées en solution, dans des conditions contrôlées, s'autoassemblent pour donner des édifices plus complexes. L'étude des interactions non-covalentes est à la base de la compréhension des systèmes biologiques comme les relations entre fonction et structure. Le monde biologique est souvent une source d'inspiration dans la modélisation d'assemblages supramoléculaires.
Origine
Elle se base pour cela sur l'établissement entre molécules déjà préexistantes d'interactions dites "non covalentes" car n'impliquant pas la création de nouvelles orbitales moléculaires. Ce concept s'oppose à la chimie dite "moléculaire", qui s'occupe des liaisons covalentes existantes au sein d'une molécule et reliant entre eux ses atomes. Bien que le nouveau système puisse acquérir des propriétés qu'il ne possédait pas avant l'établissement desdites liaisons non covalentes, chacune des molécules prenant part à la nouvelle "supermolécule" ne voit en rien son intégrité chimique modifiée. Cependant, l'architecture de l'assemblage supramoléculaire peut faire en sorte que certaines molécules soient rendues plus réactives par perturbation de leur nuage électronique ou déformation de leurs angles de liaison. Le rapprochement au sein de l'entité supramoléculaire de deux molécules naturellement enclines à réagir ensemble peut aussi les pousser à réagir plus facilement que si elles avaient été libres dans un solvant. On parle alors de catalyse supramoléculaire (les enzymes sont l'exemple le plus connu de catalyseur supramoléculaire biologique).
Les différents mode d'interactions
Les interactions à la base de la chimie supramoléculaire peuvent être des interactions:
- de Van der Waals. De 0,1 à 1 kcal/mol, elles sont non directionnelles et augmentent avec la surface de contact.
- comme la liaison hydrogène. De 1 à 10 kcal/mol, cette liaison est directionnelle et sa force dépend de la distance entre les sites donneur et accepteur.
- aromatiques (recouvrement π-π, π-cation, π-liaison H). Ce sont des interactions non covalentes dues au recouvrement des orbitales p de cycles aromatiques avec d'autres cycles aromatiques, des orbitales p ou f de cations métalliques ou avec l'orbitale moléculaire d'un électron porté par un hétéroatome plus électronégatif (O, N, S...)
- coulombiennes (ion/ion, ion/dipôle), dipolaire (dipôle/dipôle), par polarisation (ion/molécule polarisée). De 15 à 50 kcal/mol, ces interactions électrostatiques sont non directionnelles et dépendent de la distance entre les deux entités.
- de coordination métal/ligand. De 50 à 80 kcal/mol, la directionnalité de la liaison dépend de la nature du métal et des autres constituants de sa sphère de coordination.
- ou encore le résultat d'un effet hydrophobe.
Le phénomène de reconnaissance hôte/substrat, introduit par Emil Fischer avec le concept "clé-serrure", combine souvent plusieurs de ces interactions.