Cycle du soufre - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
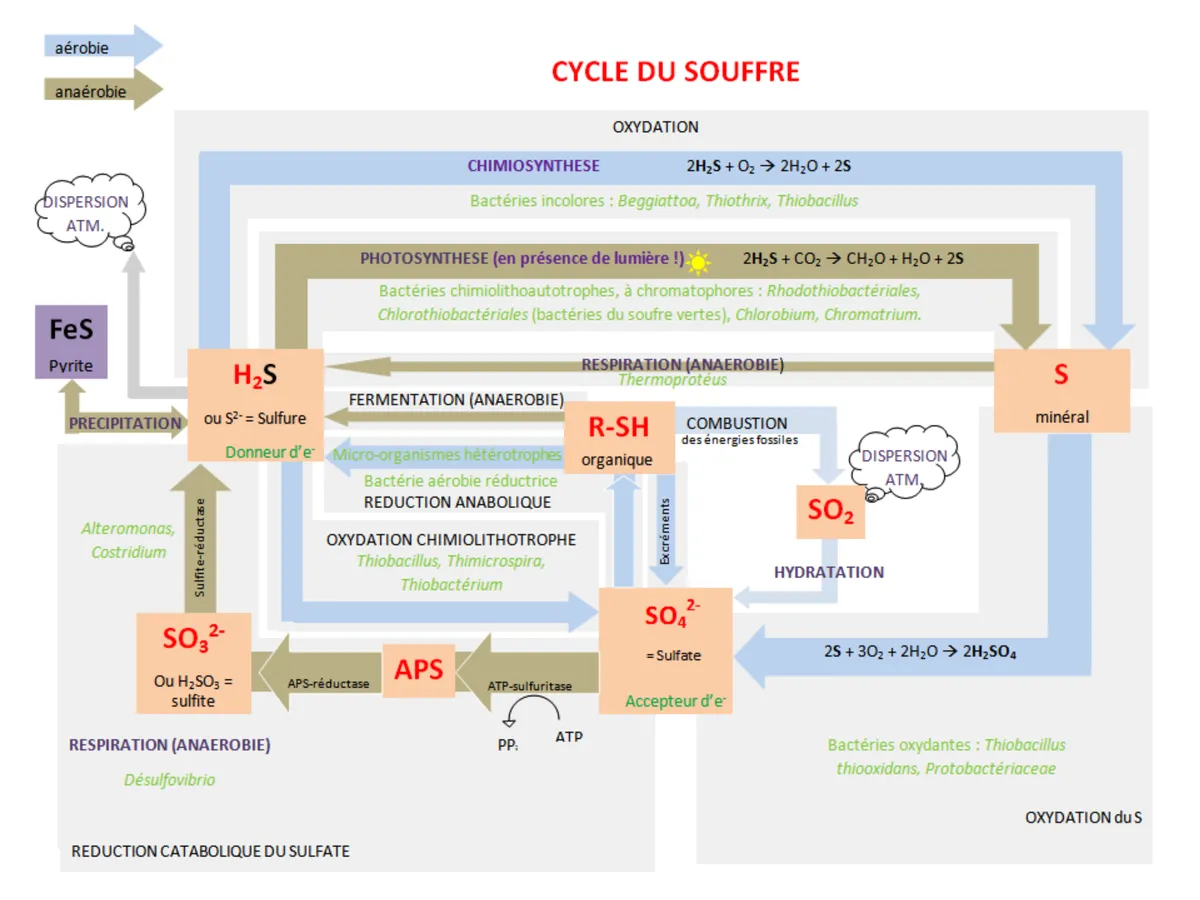
Le cycle du soufre est le cycle biogéochimique des différentes formes du soufre. Le soufre est un élément essentiel à la vie qui, comme le carbone, le phosphore, l'oxygène, l'azote ou encore l'eau, possède son propre cycle de vie. En effet, le soufre est présent partout sur Terre, atmosphère, océans, continents, mais aussi chez tous les êtres vivants sous forme de molécules organiques : les acides aminés soufrés constituants de protéines (méthionine et cystéine).
Dans l'atmosphère, on rencontre le soufre sous forme de gaz : dioxyde de soufre (SO2), hydrogène sulfuré (H2S) ; de soufre réduit comme dans le diméthylsulfure (DMS) dont la formule est CH3SCH3 et le carbonyle de sulfure (COS) ; ainsi que dans les sulfates volatiles (SO42-). Le SO2 et l'H2S proviennent de la minéralisation de la matière organique selon le pH du milieu ou du métabolisme de certaines bactéries (ex: Désulfovibrio spp.). Les volcans participent au cycle en produisant d'énormes quantités de sulfates (SO4) qui viennent s'ajouter aux sulfates issus du COS. La teneur en soufre atmosphérique peut influencer le climat planétaire par le biais des volcans car certains composés soufrés sont à la base des gouttes de pluies (formation des nuages) et peuvent également refléter une partie du rayonnement solaire. De plus, lorsque l'oxyde de soufre s'associe à l'humidité de l'air, se produit une libération d'acide sulfurique et d'acide nitrique qui retombent ensuite lors des précipitations : ce sont les pluies acides.
Dans le sol, le soufre se rencontre à l'état minéral, en grande quantité, dans les schistes bitumineux, charbon et hydrocarbures, ainsi que sous forme de sulfites et sulfates, indispensables à la croissance des végétaux. Les minéraux tels que la pyrite (FeS2) sont également riches en soufre ; ils se sont formés lors de phases sédimentaires et pourront être réintroduits dans le cycle par l'érosion et le volcanisme.
Dans l'océan, le soufre se rencontre en majorité sous forme de sulfates dissous SO42-, qui seront assimilés par des organismes, et entreront dans la composition de molécules organiques, ou sédimenteront sur les fonds. Le COS est produit en partie par l'érosion continentale, et s'échappe dans l'atmosphère par la surface des océans.
Cependant, au XXIe siècle, l'Homme, de par ses activités, produit la majorité des flux de soufre sur la planète, notamment en brûlant les combustibles fossiles tels que le pétrole et le charbon. À court terme, ce cycle n'est pas vraiment fermé, si on considère l'enfoncement des roches sédimentaires contenant du soufre dans le manteau magmatique lors d'une subduction. Ces roches pourront être réutilisées par le volcanisme à long terme
Les principales étapes du cycle du soufre sont :
- la minéralisation du soufre organique en une forme inorganique : le sulfure d'hydrogène (H2S).
- l'oxydation du sulfure, du soufre élémentaire (S) et de ses composés connexes en sulfates (SO42-).
- la réduction des sulfates en sulfures.
- l'immobilisation microbienne des composés soufrés et leur incorporation dans une forme organique du soufre.
Relations avec les autres cycles
Dans les couches terrestres, la zone de réduction des sulfates par les micro-organismes est comprise entre la zone méthanogène et la zone de réduction du fer lors d'une contamination du sol par une source de carbone. Le cycle du soufre peut interagir avec ces deux cycles. Le cycle du soufre produit de l’H2S lors de la réduction catabolique du soufre sous forme de SO42-. Le H2S, produit par exemple dans un milieu dulçaquicole, va piéger le fer sous forme de FeS2. Dans ce milieu type, le piégeage du fer va bloquer le cycle du phosphore, car le fer ne pourra plus piéger le phosphate. Le phosphate non piégé servira à la prolifération des algues et sera déterminant dans le phénomène d’eutrophisation.
Le soufre sous sa forme réduite H2S est un donneur d’électron utilisé par les bactéries phototrophes non productrices d’oxygène (ex: les bactéries vertes et bactéries pourpres sulfureuses).
Les bactéries méthanogènes entrent en compétition avec les bactéries réduisant le sulfate : la réduction du SO42- est énergétiquement plus favorable que celle du méthane. Ainsi, en milieu naturel, s’il y a plus de SO42- que de méthane, on observera plutôt un développement des bactéries sulfitoréductrices que des méthanogènes. De plus, les rejets de SO42- par les activités humaines ont une influence sur le cycle du méthane. En effet, SO42- diminue la production de méthane, réduisant ainsi le méthane atmosphérique qui joue un rôle important sur l'augmentation de l'effet de serre. De ce fait, SO42- peut être utilisé pour réduire l’effet de serre.