Dextropropoxyphène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Dextropropoxyphène | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
| No CAS | |
| Code ATC | N02 |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
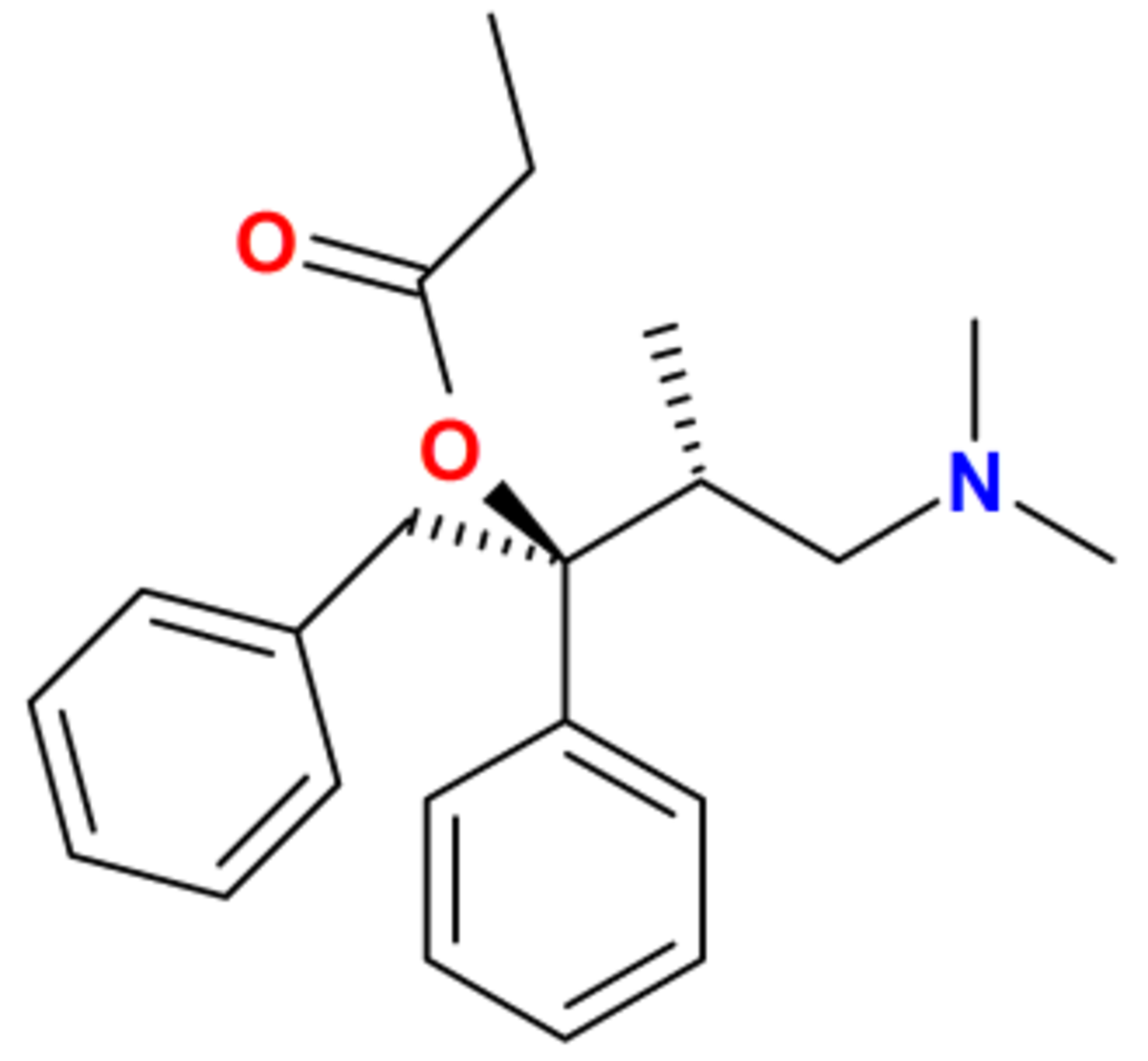
| Formule brute | C22H29NO2 |
| Masse molaire | 339,4712 ± 0,0204 g·mol-1 |
| Classe thérapeutique | |
| Antalgique opioïde faible | |
| Données pharmacocinétiques | |
| Biodisponibilité | 100 % (IV) |
| Métabolisme | Hépatique (nordextropropoxyphène) |
| Demi-vie d’élim. | 13 heures (2 - 26) |
| Excrétion | Urinaire |
| Considérations thérapeutiques | |
| Voie d’administration | Orale |
| | |
Le dextropropoxyphène (DPX) est un analgésique opioïde dérivé de la morphine. Quinze fois moins puissant que cette dernière, il est commercialisé en association à des analgésiques de faible puissance comme le paracétamol (Di-Antalvic® par exemple) et est indiqué dans les douleurs d'intensité modérée à forte (antalgique de niveau II de l’OMS).
Retrait du marché
Alors que le Di-Antalvic existait depuis environ 45 ans, l'Agence européenne des médicaments (EMA, pour European Medicines Agency) a recommandé en 2009 le retrait progressif en Europe des médicaments contenant le dextropropoxyphène du fait des risques, notamment mortels en cas de surdosage. Cela concerne une trentaine de médicaments, dont le Di-Antalvic®. L'EMA considère que « les preuves d'efficacité thérapeutique sont insuffisantes au regard du risque de décès, en cas de surdosage accidentel ou volontaire » et conclu « qu'aucune mesure complémentaire permettant de minimiser le risque ne pourrait être suffisante pour éviter les conséquences graves d'un surdosage ».
Cas de la France
Les Français étaient, de très loin, les plus gros consommateurs européens de l'association dextropropoxyphène/paracétamol, représentant à eux seuls 95% de la consommation européenne. En 2007, le Di-Antalvic y étaient le 28e médicament le plus remboursé, avec 7,4 millions de boîtes prescrites.
En France, cet avis de l'EMA a été finalement suivi par l'Agence française de sécurité sanitaire des produits de santé (Afssaps), qui estimait initialement que les médicaments contenant du dextropropoxyphène présentaient « un profil de sécurité d'emploi satisfaisant dans des conditions normales d'utilisation ». Soulignant que même si ces médicaments étaient responsables de nombreux décès suite des intoxications volontaires ou accidentelles, ce n'était pas le cas en France, où d'autres médicaments étaient choisis pour les tentative de suicide, et où le mode de conditionnement et les conditions de délivrance de ces médicaments étaient différentes.
Ainsi, alors que l'EMA constate entre 200 et 300 par an en Suède et en Angleterre, où le conditionnement en flacon favorisait le surdosage, l’agence française ne relève que 65 décès chaque année alors que huit millions de français prennent des médicaments à base de dextropropoxyphène - Une autre source rapporte 7 décès par an en France sur une enquête dans les les centres antipoison entre 1995 et 2003. D’après l’Afssaps, le rapport bénéfices/risques plaide en faveur du maintien de ce médicament en France. Avis partagé par L’Académie nationale de médecine qui estime que « cette association est utile, largement mise à profit en thérapeutique, en France, avec sécurité. Elle correspond au besoin d’antalgiques de puissance moyenne (niveau II de l’OMS), supérieure à celle du paracétamol seul et inférieure à celle des morphiniques forts. Le nombre restreint de médicaments de ce niveau II de l’OMS est à souligner ». De plus l’Académie soulignait que « la recommandation européenne ne propose pas de solution de remplacement. »
L'affsaps recommandait que les prescriptions de dextropropoxyphène/paracétamol soit remplacées soit par des antalgiques de niveau 1, « paracétamol à dose efficace, c'est-à-dire un gramme par prise, aspirine ou anti-inflammatoire non stéroïdien comme l'ibuprofène », soit par un autre antalgique de niveau 2, codéine ou tramadol, réfléchissant sur une éventuelle procédure dérogatoire pour que les patients non soulagés par les paliers 1 et intolérants aux autres paliers 2 puissent continuer à recevoir du dextropropoxyphène.

















































