Faibles doses d'irradiation - Définition
La liste des auteurs de cet article est disponible ici.
Progrès des connaissances en Radiobiologie
Mécanismes de réparation
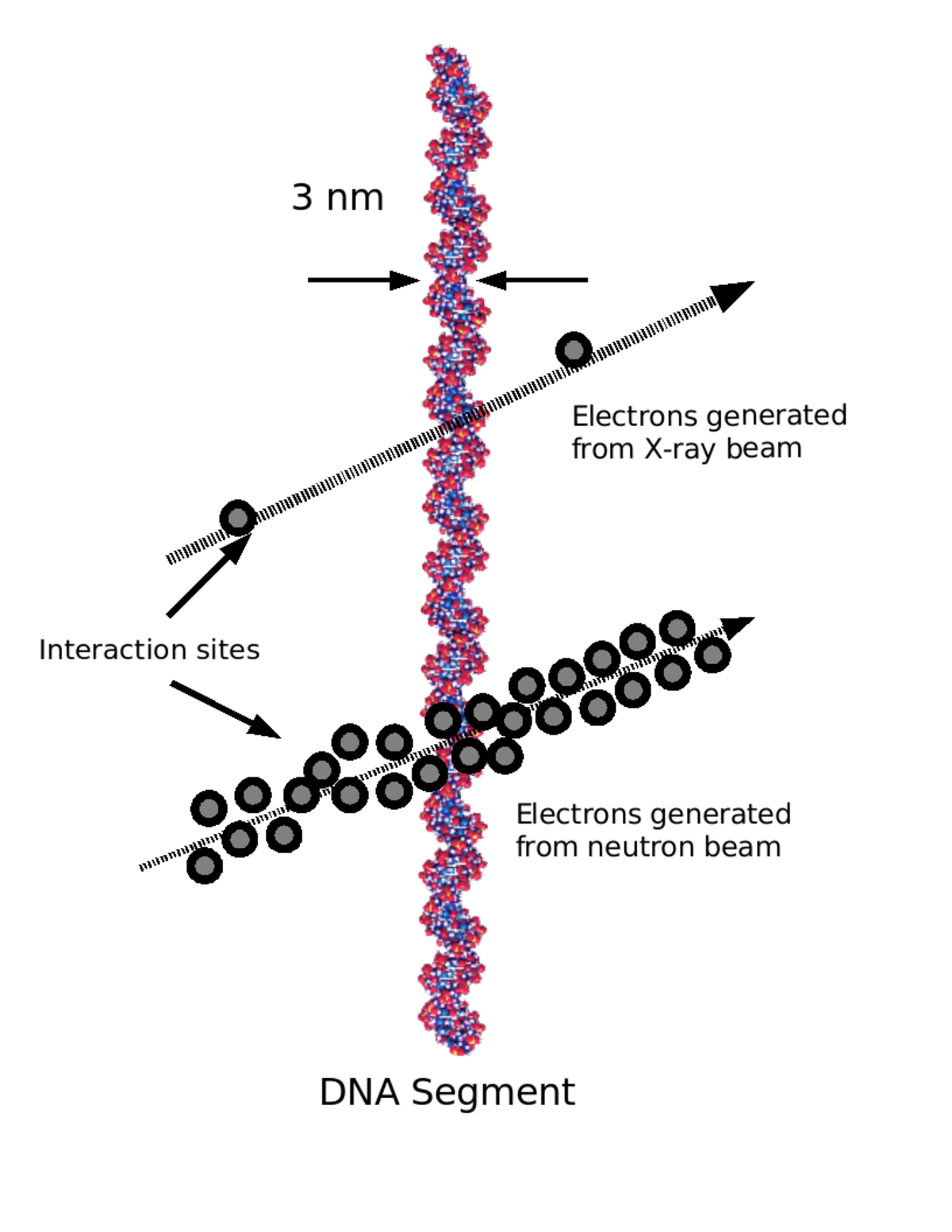
L'idée d'une loi linéaire s'appuie initialement sur l'observation des ruptures de l'ADN provoquées par les radiations ionisantes. On observe en effet que le nombre de ruptures est directement proportionnel à la dose, sans effet de seuil : il y a un effet possible dès le premier rayonnement. Cette observation de base n'est pas contestée, mais doit être complétée par l'étude du devenir de ces ruptures à travers les mécanismes que la cellule met en œuvre pour réparer l'ADN.
Les cellules subissent en permanence de nombreuses ruptures de l'ADN, qu'elle doivent en permanence réparer. La réparation des lésions fait intervenir les enzymes les plus remarquables que l'on connaisse. « Les ruptures simple brin sont réparées en quelque secondes ou minutes. La plupart des autres lésions sont réparées en quelques heures. »
L'étude de l'effet des rayonnements ionisants sur les dommages de l'ADN montre que les dommages constatés sont qualitativement les mêmes ceux que subissent spontanément les cellules, mais pas leur distribution. Toutes proportions gardées, l'exposition d'une cellule à des rayonnements ionisants augmente la proportion de cassures double brin et de ponts ADN/ADN et ADN/protéine.
| Dommage ADN | Lésions spontanées/cellule/j | Lésions radio-induites/Gy | 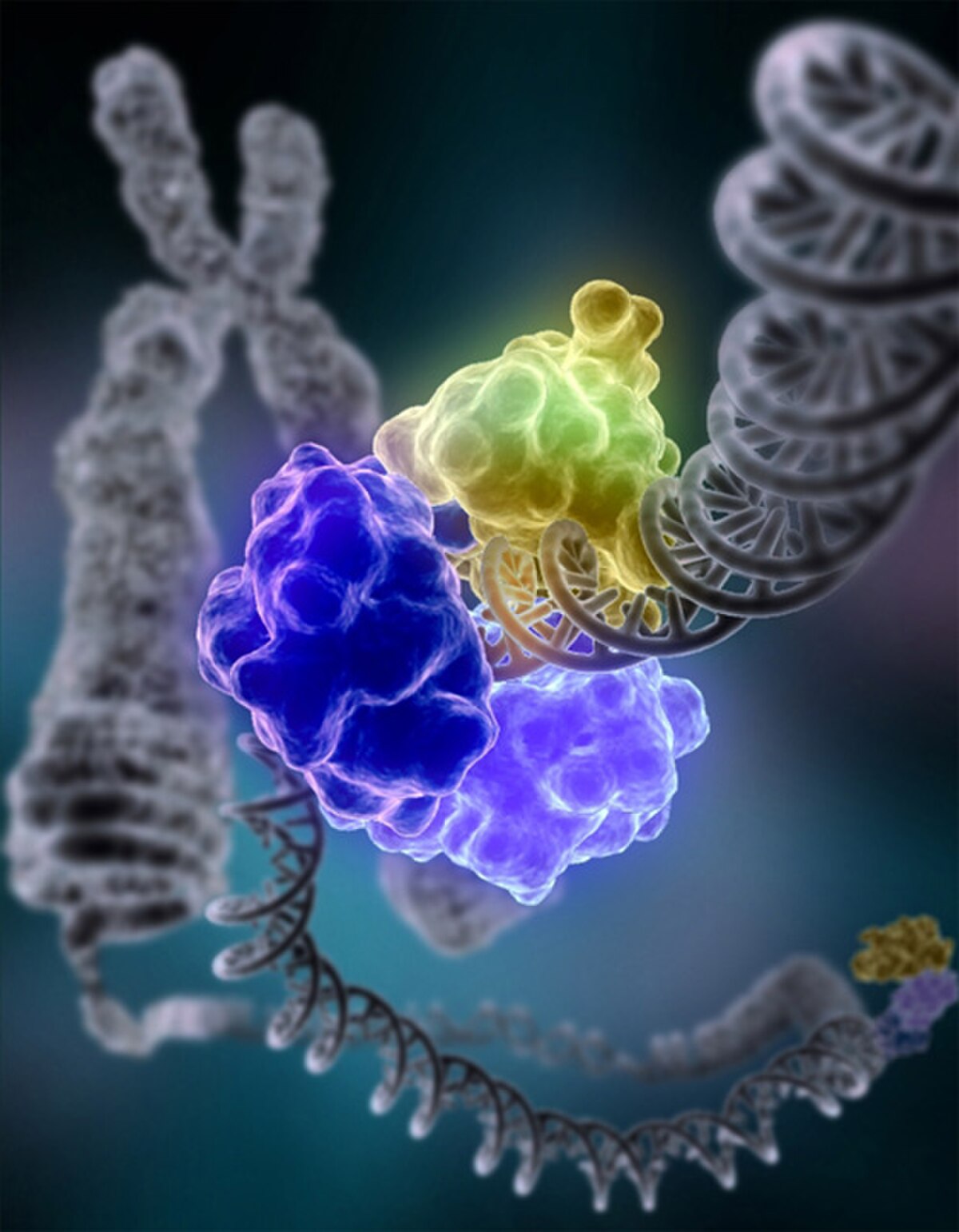
Réparation de l'ADN : DNA ligase I réparant des dommages causés à un chromosome |
| Cassures simple brin | 10 000 à 55 000 | 1000 | |
| Perte de base | 12 600 | Non évaluée | |
| Dommage de base | 3 200 | 2 000 | |
| Cassure double brin | 8 | 40 | |
| pont ADN/ADN | 8 | 30 | |
| pont ADN-proteine | quelques | 150 | |
| sites multilésés | Non évalué | quelques |
L'existence d'un système de réparation n'est pas en soi une objection à l'hypothèse linéaire. Les effets stochastiques des rayonnements sont la conséquence lointaine des erreurs de réparations, et il n'y a pas de raison de supposer que ces erreurs disparaissent en dessous d'un certain seuil : à partir du moment où un taux d'erreur existe, les erreurs du système se produiront en proportion de la dose.
Cependant, les travaux récents sur la réparation de l'ADN montrent que certains systèmes intracellulaires qui gouvernent la réparation ne sont déclenchés qu'au-dessus d'un seuil d'irradiation. À partir du moment où ces mécanismes de réparation sont activés par une irradiation suffisante, le métabolisme cellulaire est modifié, et la réponse de la cellule aux irradiations ultérieures change de nature. La diminution après une première irradiation à faible dose de la radiosensibilité in vivo et in vitro est bien établie (phénomène d’adaptation).
Au-dessous de ce seuil, les défauts créés par les faibles doses et débits de dose ne sont pas réparées, et entraînent la mort de ces cellules. On constate expérimentalement une hypersensibilité individuelle des cellules aux très faibles doses, l'effet macroscopique de cette hypersensibilité étant plus que compensé par la faiblesse de la dose. Cette hypersensibilité, qui ne se manifeste plus pour des débits de dose importants, montre que la nature de la réaction cellulaire dépend de la dose. Elle montre également que certains effets, qui n'apparaissent qu'à faible dose, sont donc nécessairement sous-estimés par la loi « linéaire sans seuil », même s'il n'est pas possible de déterminer si ces effets sont nocifs pour l'organisme dans son ensemble.
L'effet à long terme dépend donc de la dose et du débit de dose : pour de nombreux gènes, la transcription des gènes cellulaires est modifiée par des doses beaucoup plus faibles (de l’ordre du mSv) que celles pour lesquelles on observe une mutagenèse ; et donc selon la dose et le débit de dose ce ne sont pas les mêmes gènes qui sont transcrits.
- Pour des très faibles doses d'irradiation (<10 mSv), les lésions ne sont pas réparées et le contrôle qualité de la cellule fonctionne en tout ou rien. Les lésions sont éliminées par la disparition des cellules, soit directement par apoptose (suicide cellulaire programmé par l'apparition d'un génome anormal), soit au moment d'une mitose ultérieure (l'anomalie génétique empêchant la division cellulaire, mais pas son fonctionnement). Pour ces faibles doses et débits de doses, les anomalies sont suffisamment rares pour que l'élimination des cellules anormales n'entraîne pas d'effet somatique sur le tissu.
- Des doses un peu plus élevées endommageant un nombre notable de cellules, et sont donc susceptibles de causer des lésions tissulaires. Pour des doses comprises entre 10 et 100 mSv, les systèmes de réparation de l’ADN sont activés. La réparation permet alors la survie cellulaire, mais peut générer des erreurs. Le nombre de réparations fautives mutagènes est petit mais son importance relative, par unité de dose, croît avec la dose et le débit de dose.
Par la suite, une mutation sera transmise lors de la division cellulaire, mais l'évolution de la cellule anormale dépendra de son environnement : le processus de cancérogenèse se heurte à des mécanismes efficaces de défense à l’échelle du tissu et de l’organisme, qui doivent eux-mêmes être mis en défaut pour qu'un cancer apparaisse.
Effet « bystander »
Un effet de proximité (en anglais, « bystander » désigne celui qui assiste à un accident) a été identifié dans certaines expériences, en particulier des thérapies anti-tumorales. On s'est aperçu depuis quelques années que la réponse d'un tissu exposé à des radiations était coordonnée, faisant intervenir des réponses y compris de la part de cellules qui n'avaient pas été elles-mêmes irradiées. Les mécanismes impliqués ne sont pas éclaircis, mais ces études montrent qu'il n'y a pas de relation dose-effet simple aux faibles doses, que les cellules qui déclenchent une mort programmée par apoptose ne sont pas nécessairement celles qui ont été irradiées (!) et que les irradiations peuvent déclencher des instabilités du génome persistant sur plusieurs générations cellulaires.
Ce domaine est à peine exploré, mais il est clair que si l'effet d'une faible dose d'irradiation est une réponse globale du tissu, la relation dose-effet peut présenter des seuils et des hystérésis, et aussi bien être en forme de "J" avec effet de seuil ou en forme de "n" avec une sur-réaction aux faibles doses. La seule chose certaine est que la logique justifiant le modèle « linéaire sans seuil », qui présuppose l'addition de réponses indépendantes de chaque cellule isolée, n'a pas de justification réelle, et qu'il n'est pas possible d'extrapoler aux faibles doses d'irradiation les effets observés aux doses plus fortes.
Cancérogenèse
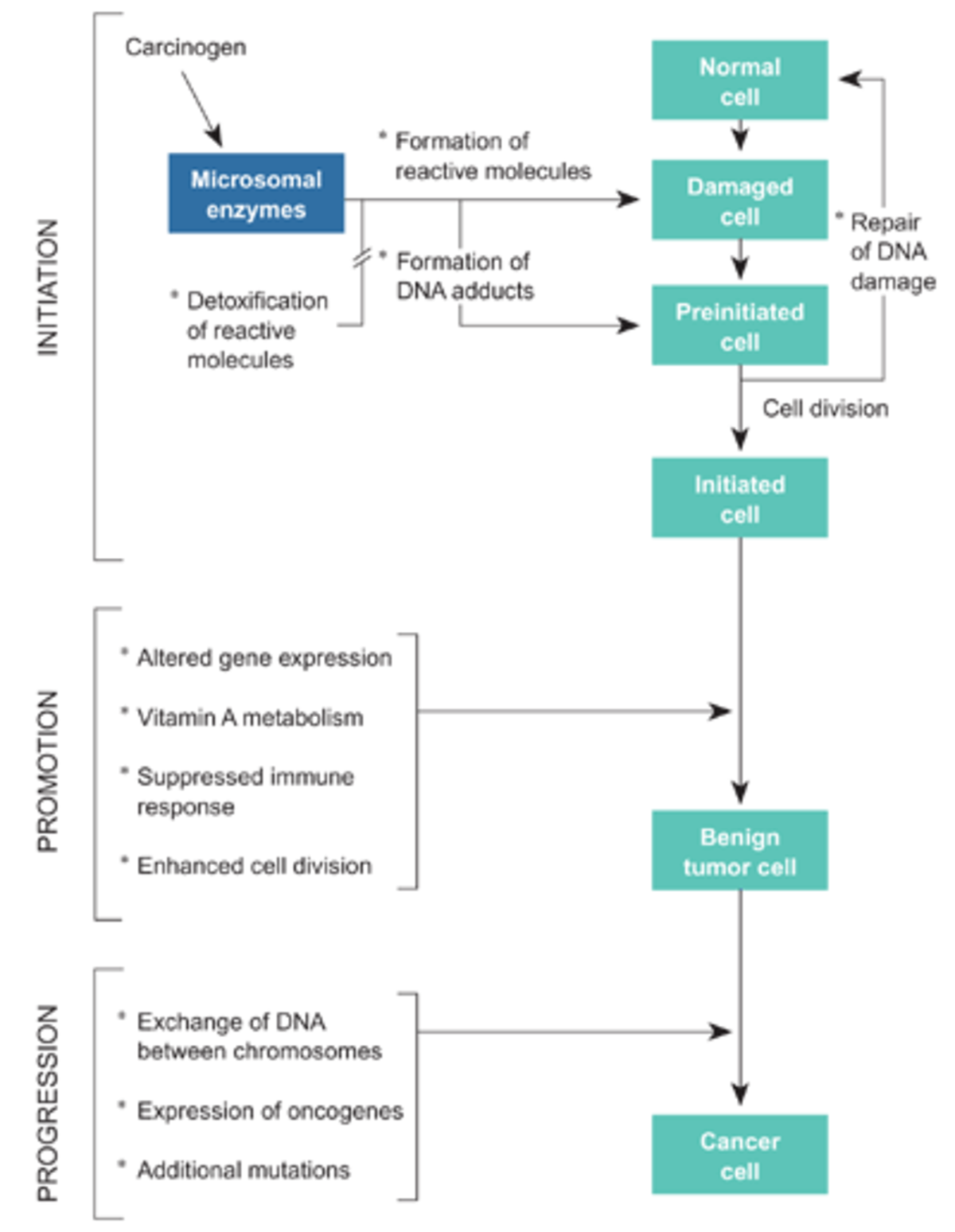
On pensait que la cancérogenèse était initiée quand une lésion de l'ADN atteignait quelques cibles spécifiques : c'est ce modèle relativement simple qui avait justifié la relation « linéaire sans seuil ». Les études plus récentes ont révélé qu'en réalité ce processus de cancérogenèse d'une cellule isolée se heurte à des mécanismes efficaces de défense à l’échelle du tissu et de l’organisme, par un processus complexe faisant intervenir des relations complexes entre la cellule initiée et les cellules environnantes.
Au niveau du tissu, les mécanismes qui interviennent dans l’embryogenèse (et pour diriger la réparation tissulaire après une agression) semblent jouer un rôle pour contrôler la prolifération d’une cellule, même quand celle-ci est devenue autonome. Ce mécanisme pourrait expliquer l’absence d’effet cancérogène après contamination par de faibles quantités de radioéléments émetteurs α (phénomène dans lequel un petit nombre de cellules ont été fortement irradiées mais sont environnées par des cellules saines) avec l’existence, dans ce cas, d’un seuil chez l’homme comme chez l’animal. L'effet biologique des irradiations ne paraît pas déterminé par le nombre de mutations élémentaires qu'elles créent, mais par leur poids sur le système de régulation biologique qui compense en permanence l'agression de l'ADN par les agents oxydants.
« Vu le mécanisme en plusieurs étapes de la carcinogenèse, on ne sait pas si la linéarité dose-effet pour la lésion primaire complexe de l'ADN et les lésions cellulaires fixées, qui sont critiques, entraîne une relation dose-effet linéaire en ce qui concerne les cancers induits par l'exposition aux rayonnements. »