Historique du concept de molécule - Définition
La liste des auteurs de cet article est disponible ici.
XXe siècle
Au début des années 1900, le chimiste américain Gilbert N. Lewis commença à dessiner des points lors de ses cours de chimie undergraduate à Harvard, afin de représenter les électrons présents autour des atomes. Ses étudiants appréciaient ces dessins et ceci l'encouragea à continuer dans cette direction. À partir de ses cours, Lewis s'aperçut que les éléments possédant un certain nombre d'électrons semblaient posséder une stabilité plus importante. Ce phénomène fut repéré par le chimiste allemand Richard Abegg en 1904, et Lewis s'y référait en lui donnant le nom de loi d'Abegg pour la valence et contre-valence. Lewis se rendit compte qu'une fois qu'un groupe de 8 électrons s'est formé autour d'un noyau, alors la couche est complète et une nouvelle couche commence à être remplie. Lewis s'aperçut aussi que les ions dont la couche extérieure est remplie de 8 électrons possèdent une stabilité particulière. À partir de ces observations, il proposa la règle de l'octet : les ions ou atomes comportant une couche remplie de 8 électrons ont une plus grande stabilité.
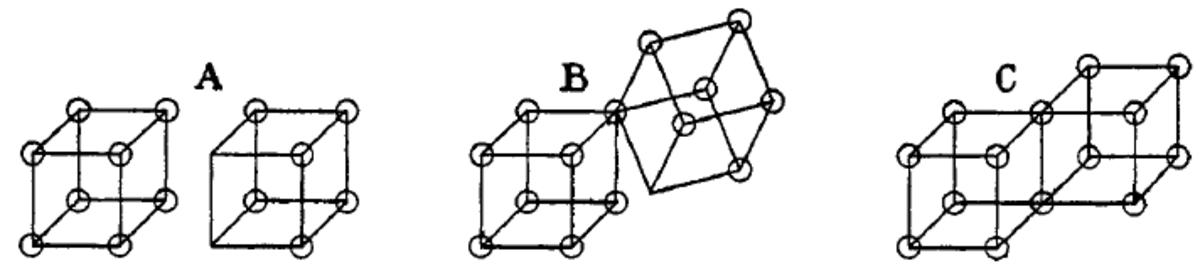
Par la suite, Lewis envisage l'atome comme ayant 8 sites disponibles pour les électrons, à la manière des coins d'un cube. Ainsi, il conçoit en 1902 une théorie selon laquelle ces atomes cubiques peuvent s'associer en formant des liaisons sur leurs côtés et ainsi créer des molécules de structures cubiques.
Autrement dit, des liaisons covalentes simples peuvent être formées lorsque 2 atomes partagent une arête et mettent en commun deux électrons, comme dans la structure C ci dessous. De la même façon, des liaisons ioniques sont formées par le transfert d'un électron d'un cube à l'autre, sans qu'ils ne partagent une arête (structure A). Lewis postule l'existence d'un état intermédiaire où seulement un coin est partagé (structure B).
Les doubles liaisons, qui résultent du partage de 4 électrons, sont donc formées par le partage d'une face entre deux atomes cubiques.
En 1913, alors qu'il travaille comme directeur du département de chimie de l'Université de Californie à Berkeley, Lewis lit une première version d'un article écrit par un étudiant en thèse anglais, Alfred Lauck Parson. Ce dernier suggérait que l'électron n'est pas seulement une charge électrique mais aussi un petit aimant (ou magnéton comme il le désigne) et qu'en outre, une liaison chimique est le résultat du partage des deux électrons entre deux atomes. Ceci, selon Lewis, signifiait que la liaison se formait quand deux électrons étaient partagés sur une arête entre deux cubes différents.
Afin de pouvoir représenter les atomes et les molécules, Lewis introduit la « structure de Lewis » dans son article de 1916 L'atome et la molécule. Il se sert de points pour représenter les électrons et de lignes pour les liaisons covalentes. Dans cette publication, il développe le concept de liaisons covalentes, dans lesquelles deux atomes peuvent partager de un à six électrons, formant de cette manière soit la liaison électron simple, une liaison simple, une liaison double ou une liaison triple.
XIXe siècle
D'une manière similaire, John Dalton, en 1803, prend le poids atomique de l'hydrogène, l'élément le plus léger, comme unité, et détermine, par exemple, que le rapport pour l'anhydride d'azote était de 2 pour 3 ce qui donne la formule N2O3. Dalton imagine, à tort, que les atomes "s'accrochent" ensemble pour former des molécules. Plus tard, en 1808, Dalton publie son célèbre diagramme des "atomes" combinés :
Amedeo Avogadro déclare dans son célèbre article de 1811 Essay on Determining the Relative Masses of the Elementary Molecules of Bodies, que :
Il convient de signaler ici que cette citation est une traduction littérale. Avodagro utilise le terme « molécule » de manière similaire pour les atomes et les molécules. De manière spécifique, il utilise le terme « molécule élémentaire » lorsqu'il fait référence aux atomes et de « molécules composites » pour décrire la matière.