Historique du concept de molécule - Définition
La liste des auteurs de cet article est disponible ici.
Antiquité
Vers 485 av. J.-C., le philosophe grec Parménide se fonde sur un argument ontologique contre le néant, niant la possible existence du vide. En 460 av. J.-C., le philosophe grec Leucippe, en opposition à Parménide, qui nie le vide, propose une théorie atomique, qui explique la raison pour laquelle tout dans l'univers est composé d'atomes ou de vide. Une théorie qui, selon Aristote, a été conçue pour contredire exprès les arguments de Parménide. Dans les années qui suivront, spécifiquement vers 450 av. J.-C., le disciple de Leucippe, Democritus, continue à développer l'hypothèse atomique en utilisant le terme atomos, ce qui signifie littéralement l’« insécable ».
En plus des théories atomiques et avant le développement du concept de « molécule » s'établissent diverses théories essentielles d'élément. Dès le VIe siècle av. J.-C., le scientifique grec Thalès de Milet pensait que l'élément essentiel était l'eau et que toutes les choses dérivaient de cet élément. Selon la légende, Thalès marchait le long d'un chemin de flanc de coteau sur le rivage de Ionia, dans ce qui est aujourd’hui le sud-ouest de la Turquie, et il remarqua des roches contenant des fossiles qui étaient sans aucun doute possible des coquillages marins. Cela a mené Thales à croire que ces collines avaient dues autrefois faire partie de la mer. Sur cette logique, Thalès établit que le monde original devait avoir été entièrement composé d'eau, et que c'était donc l'élément essentiel.
Au Ve siècle av. J.-C., le Grec Empédocle, étant influencé par Pythagore, proclame que toutes les choses sont composées des combinaisons différentes de quatre éléments :
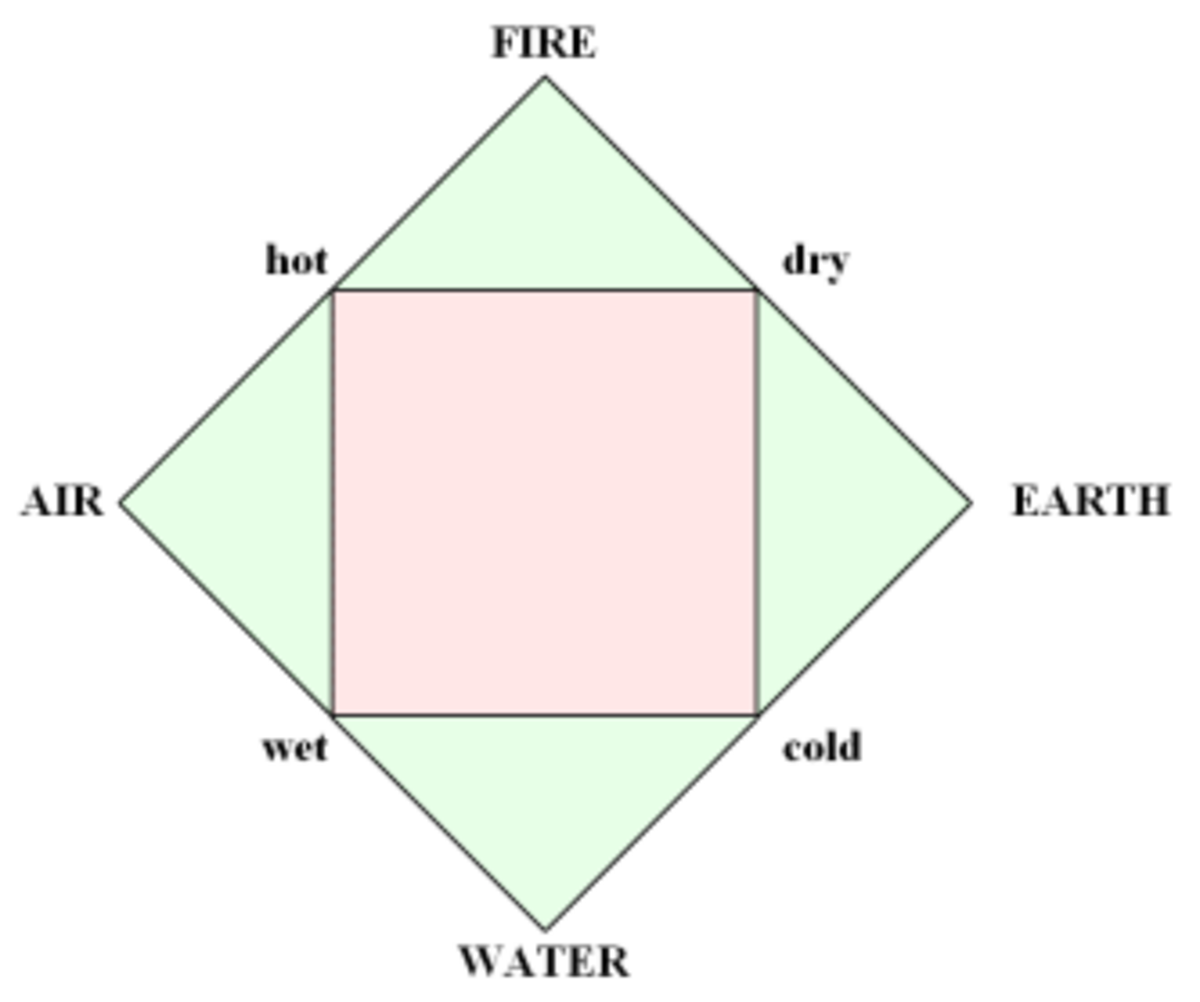
Le terme « élément » (stoicheia) a été introduit pour la première fois par le philosophe grec Platon vers 360 av. J.-C. dans son dialogue Timée, qui comporte une discussion sur la composition des corps organiques et inorganiques et qui peut être considéré comme un traité rudimentaire de la chimie. Platon suppose que la particule fondamentale de chaque élément possède une forme géométrique précise : tétraédrique (feu), octaédrique (air), icosaédrique (eau), et cubique (terre).
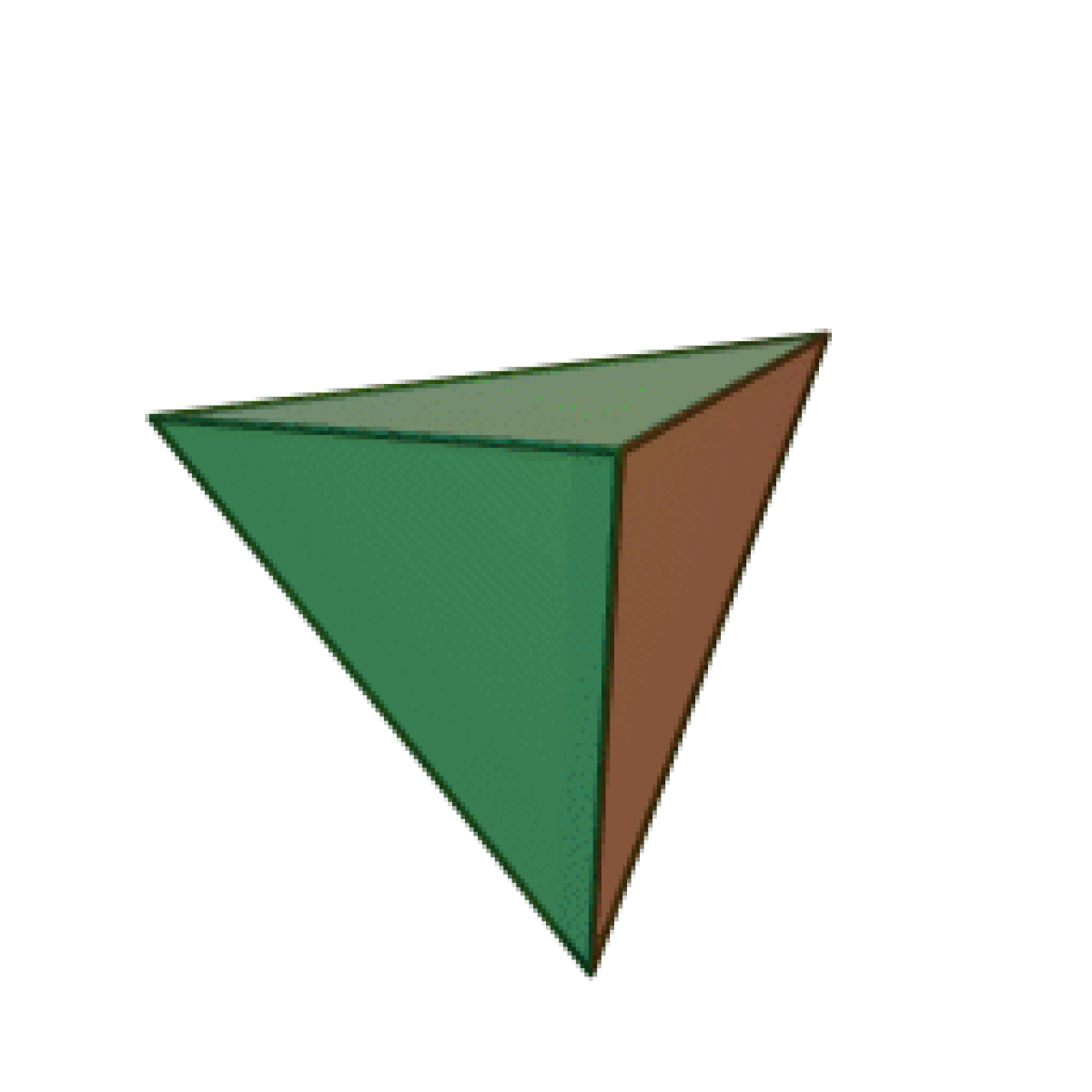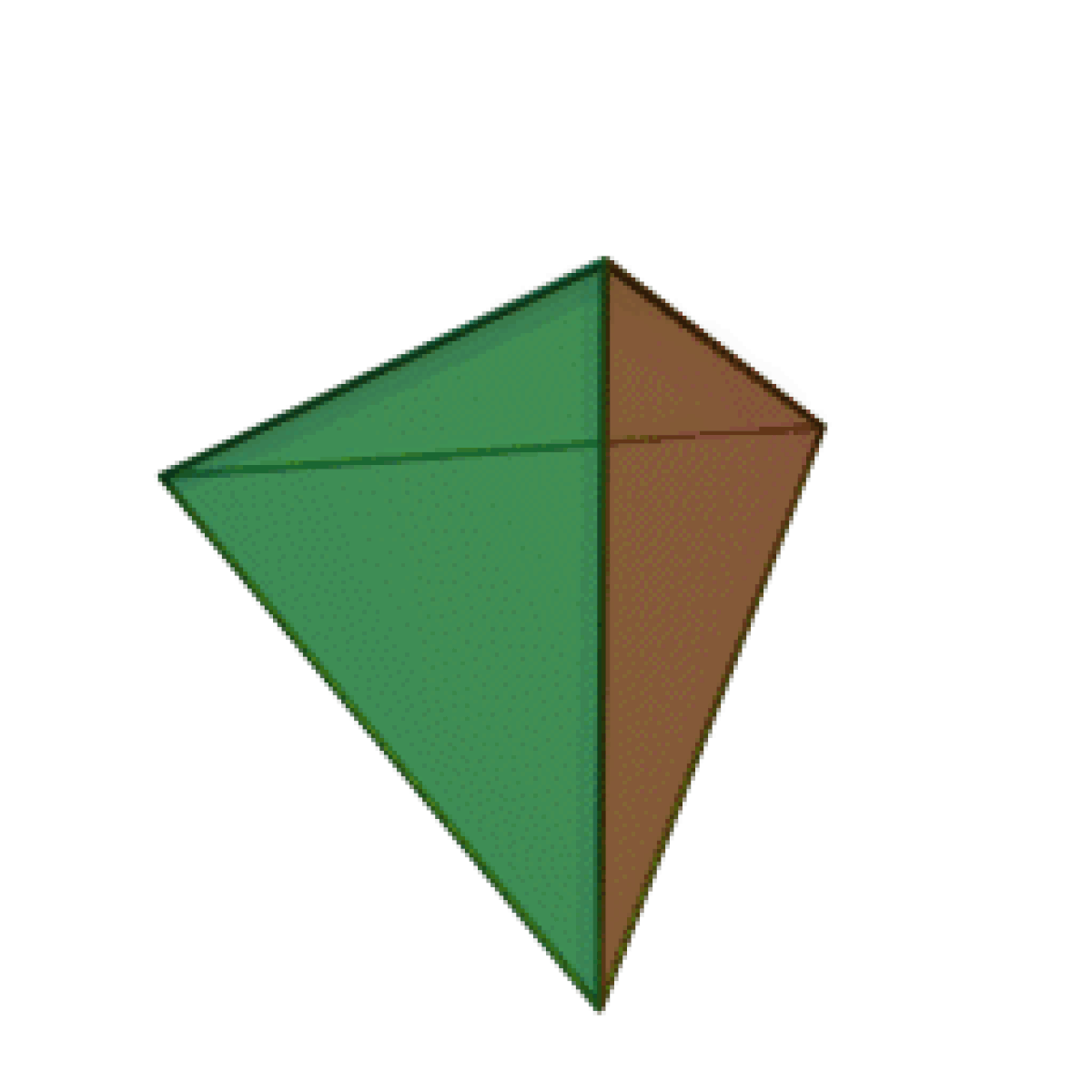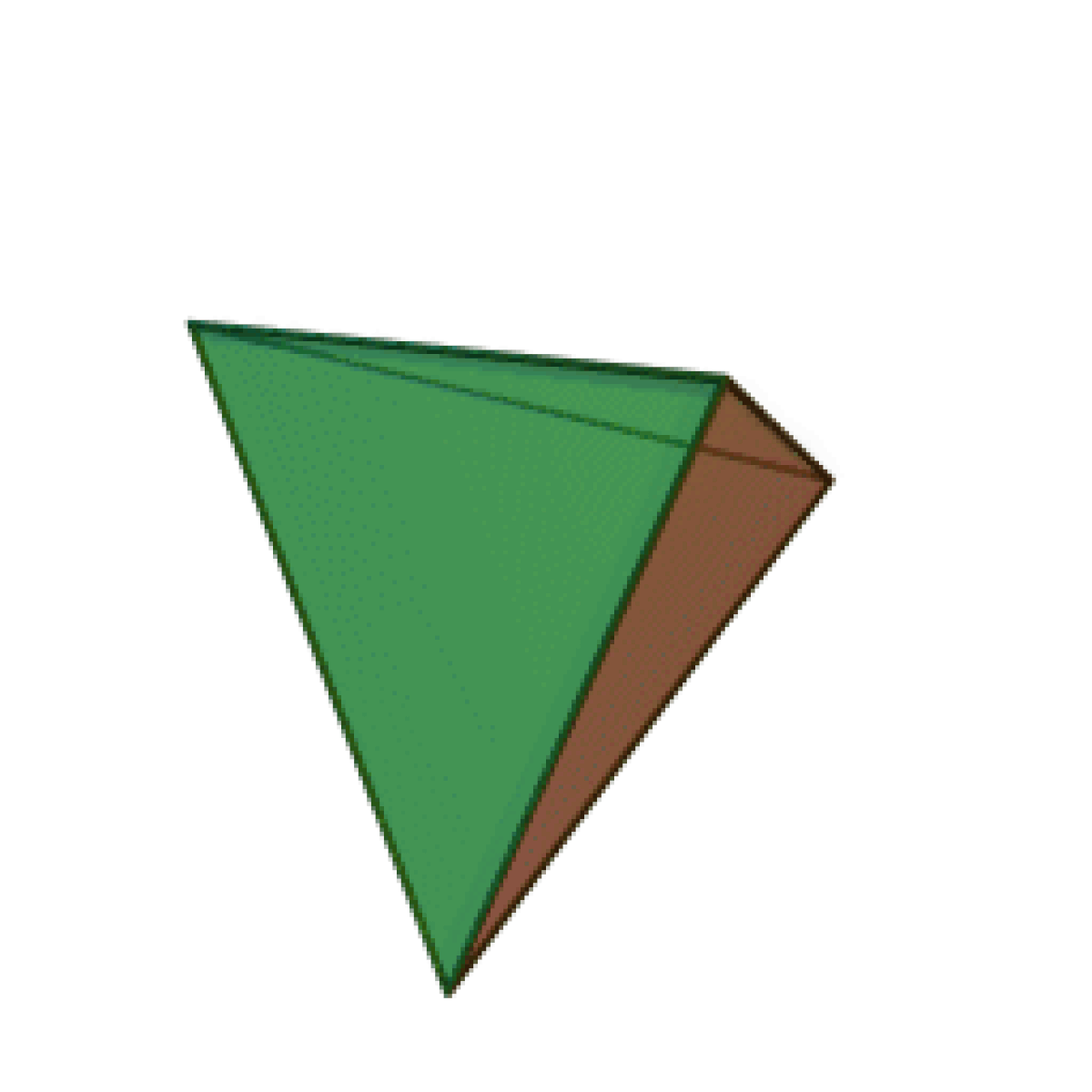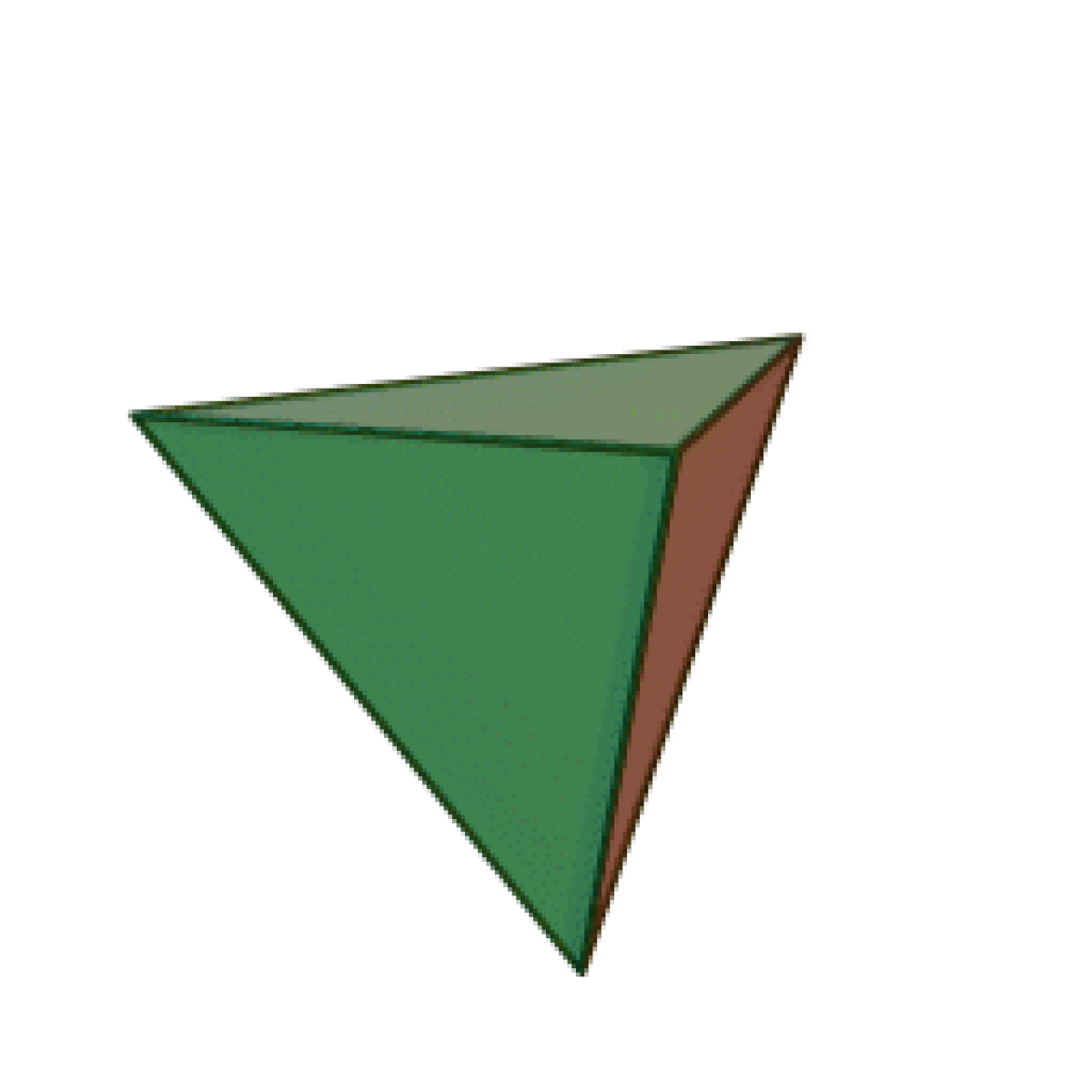 | 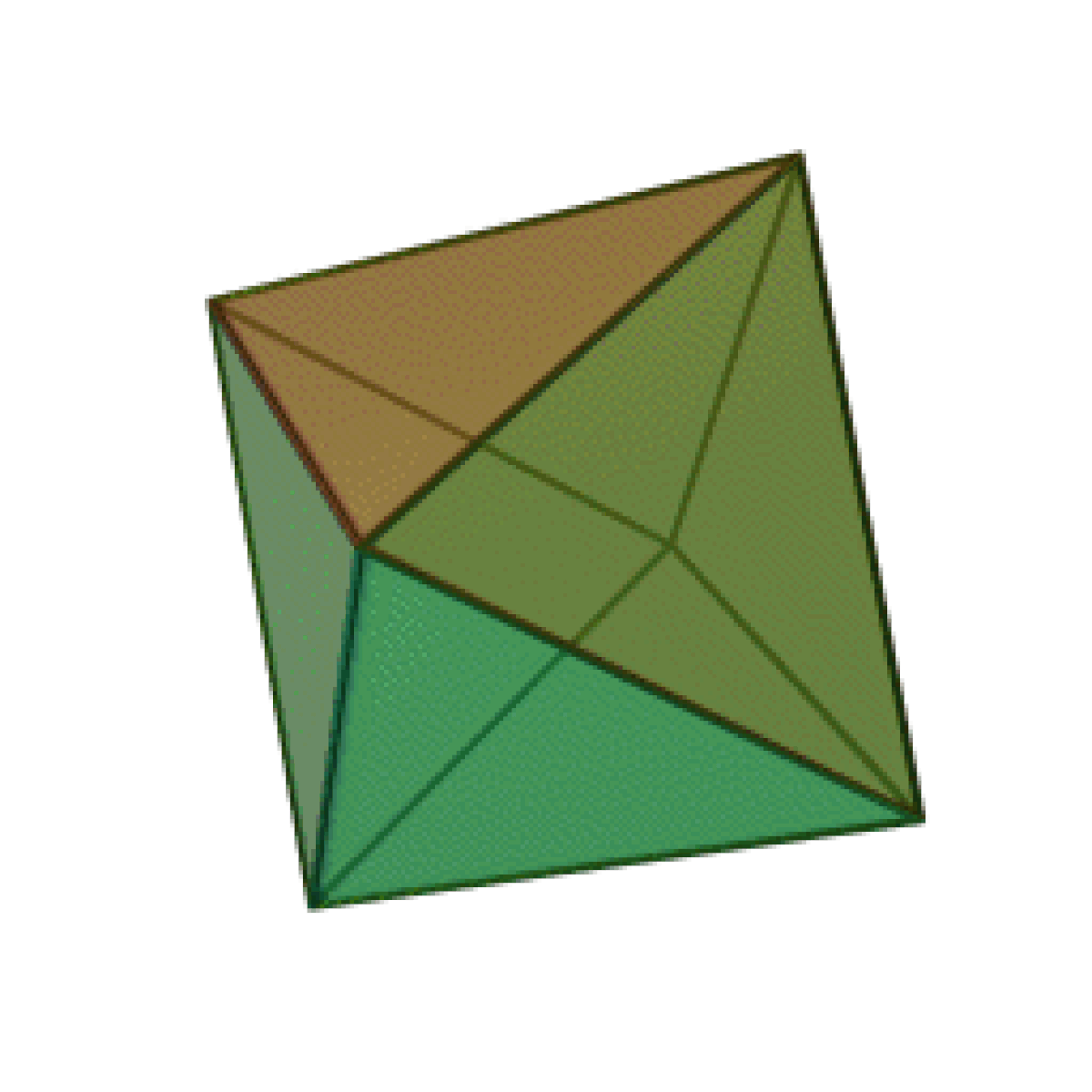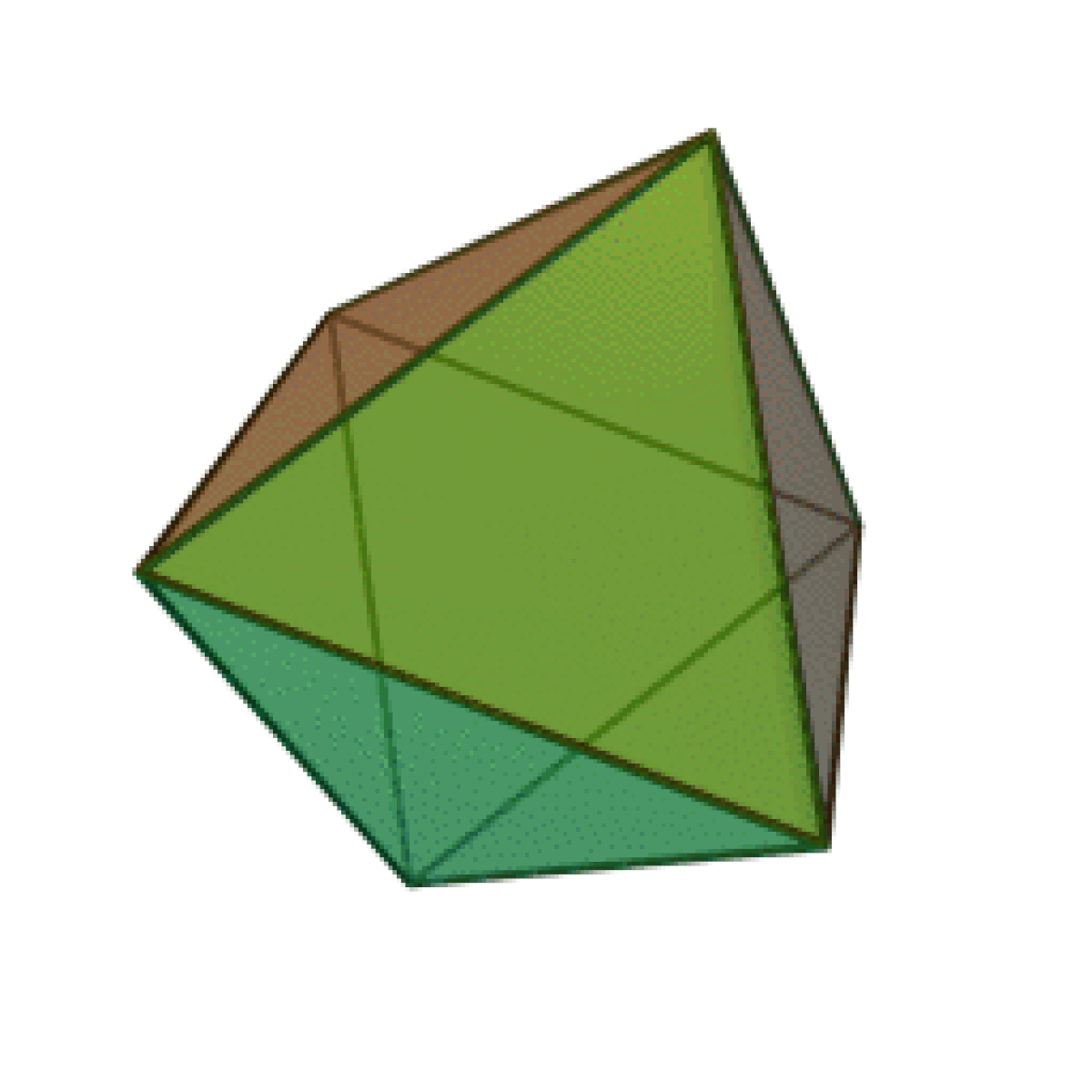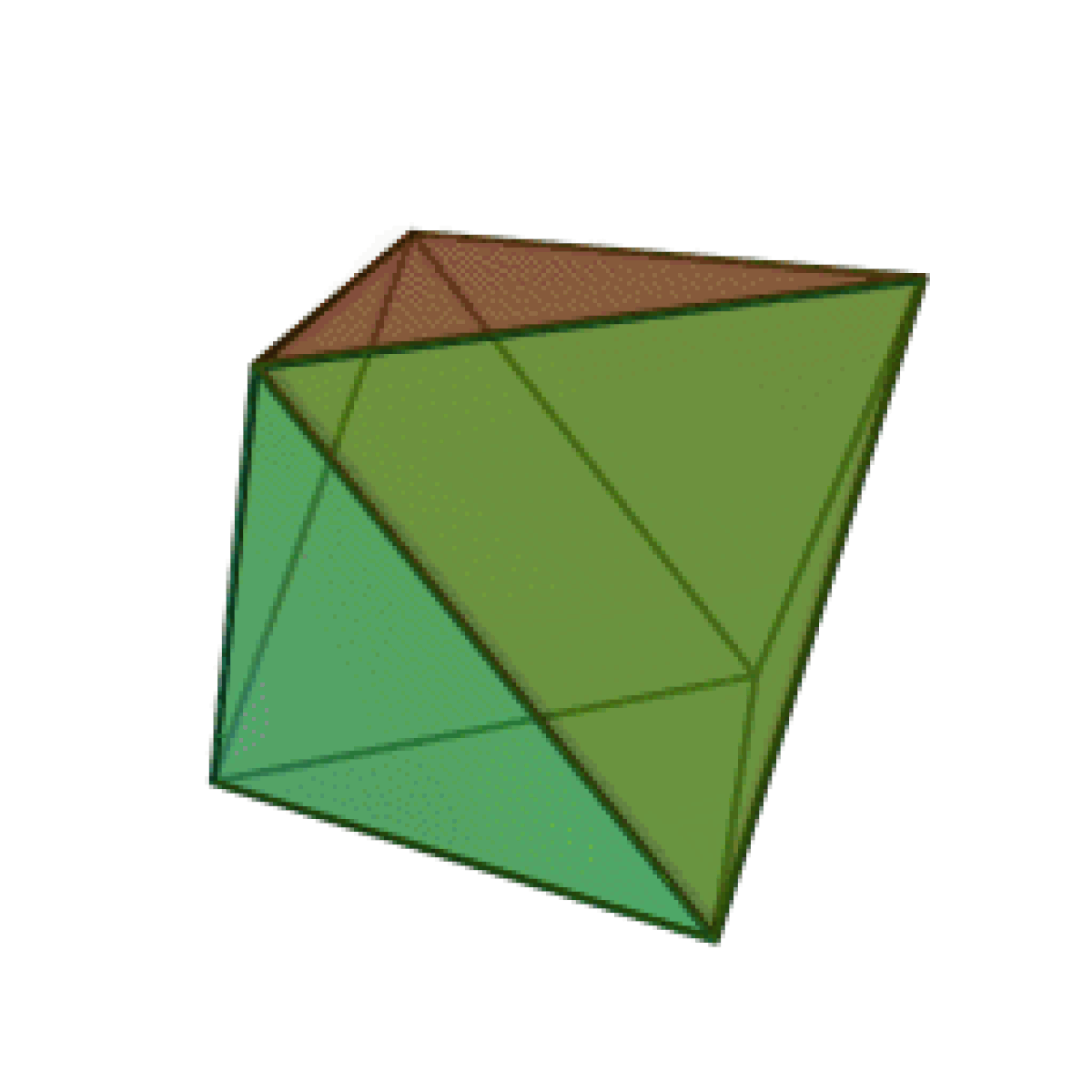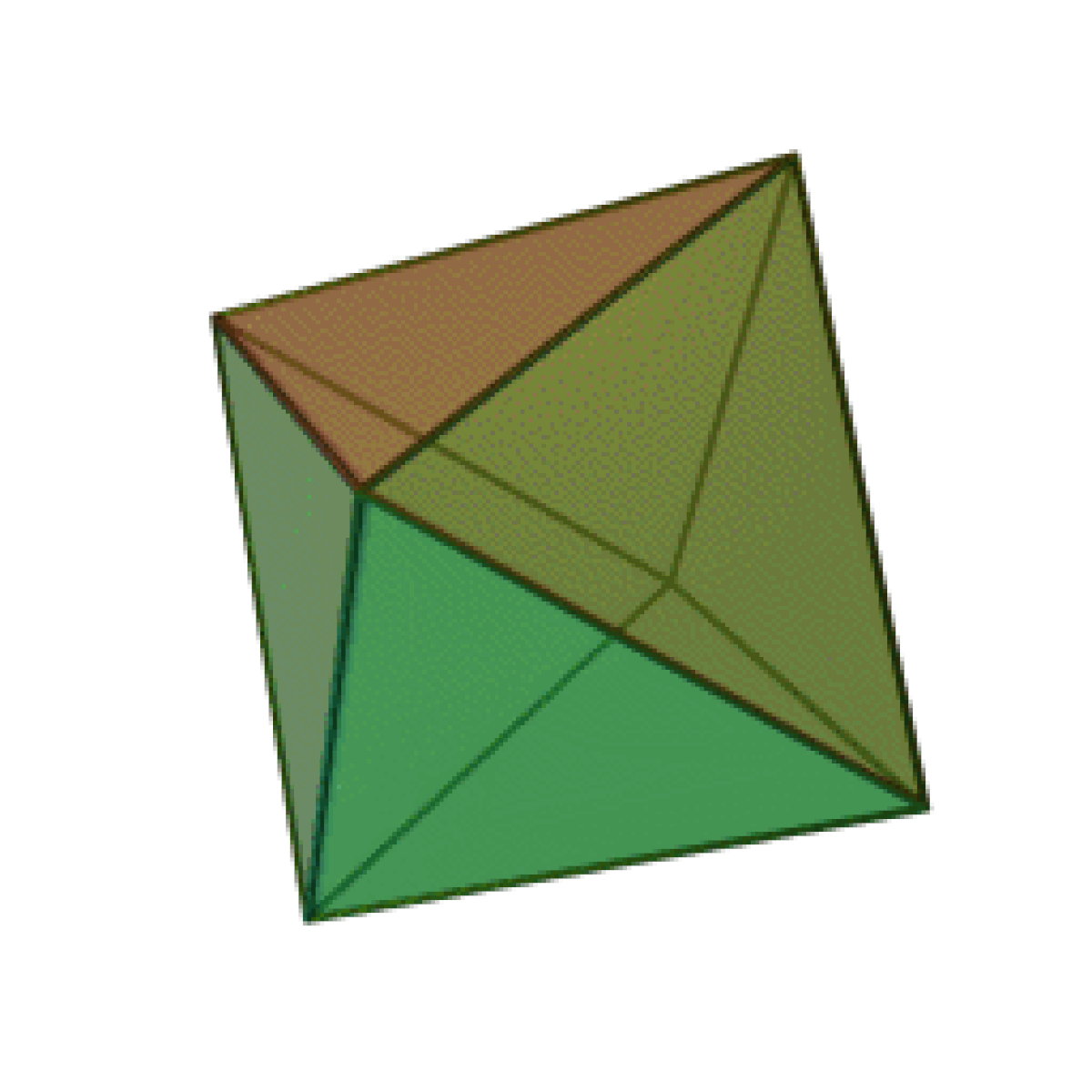 | 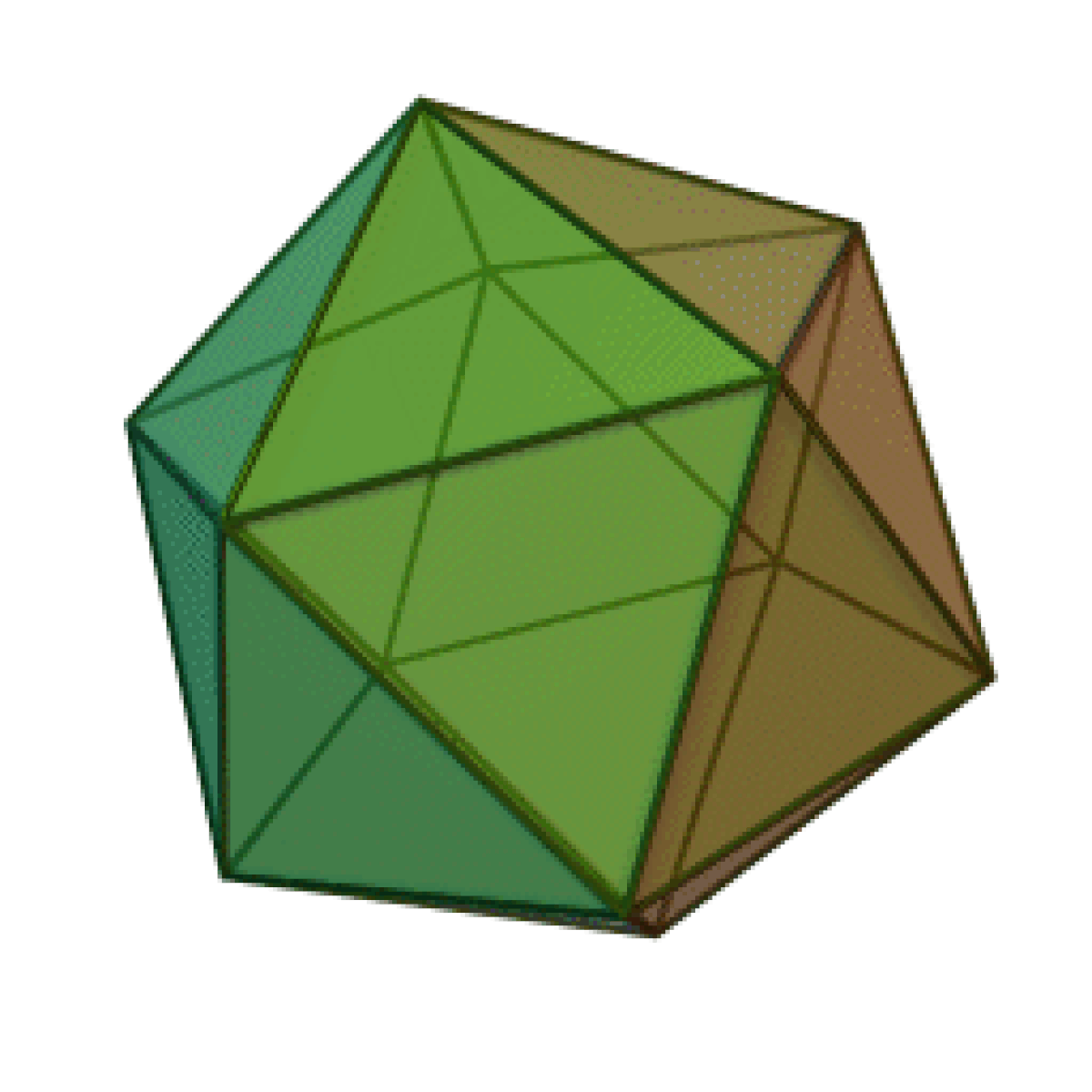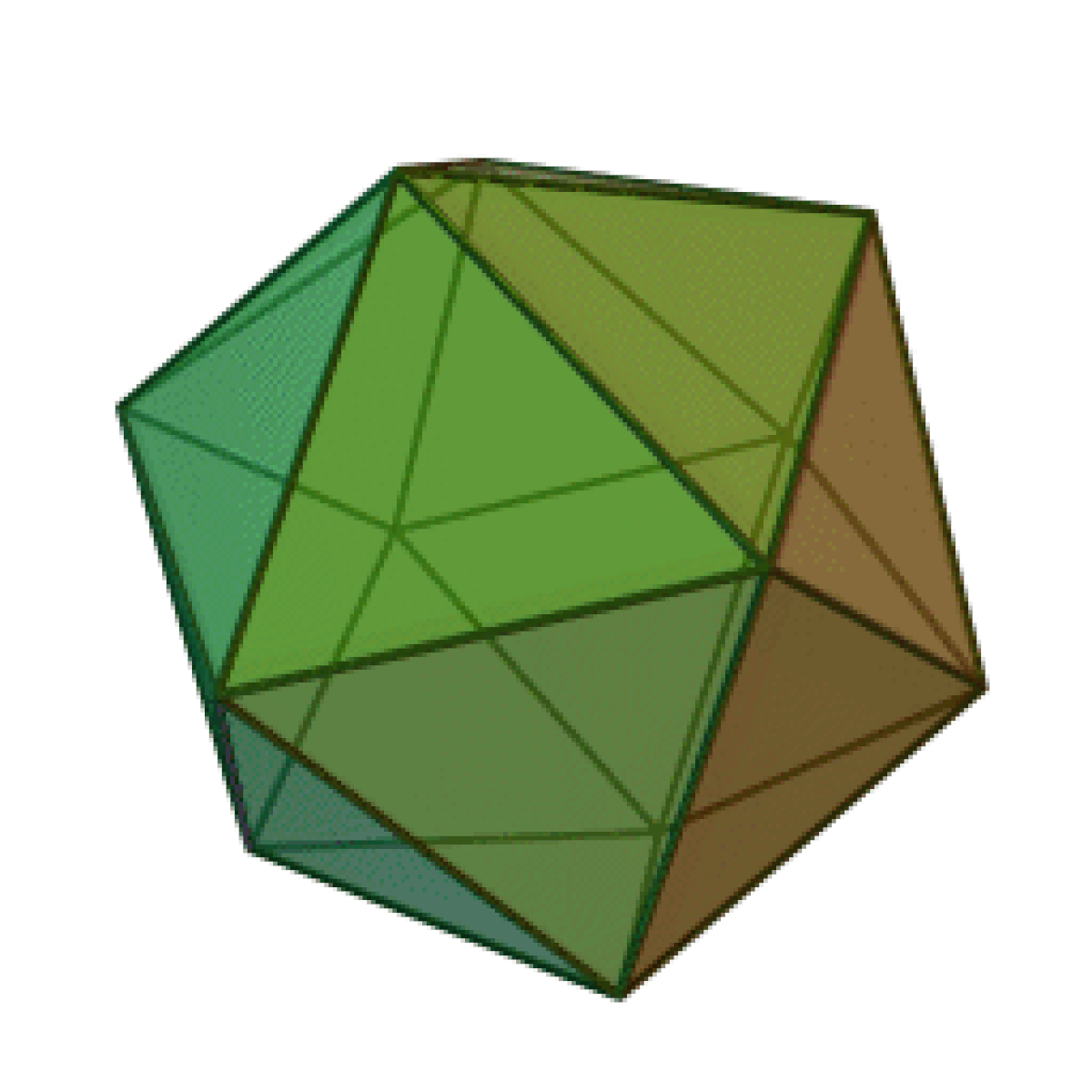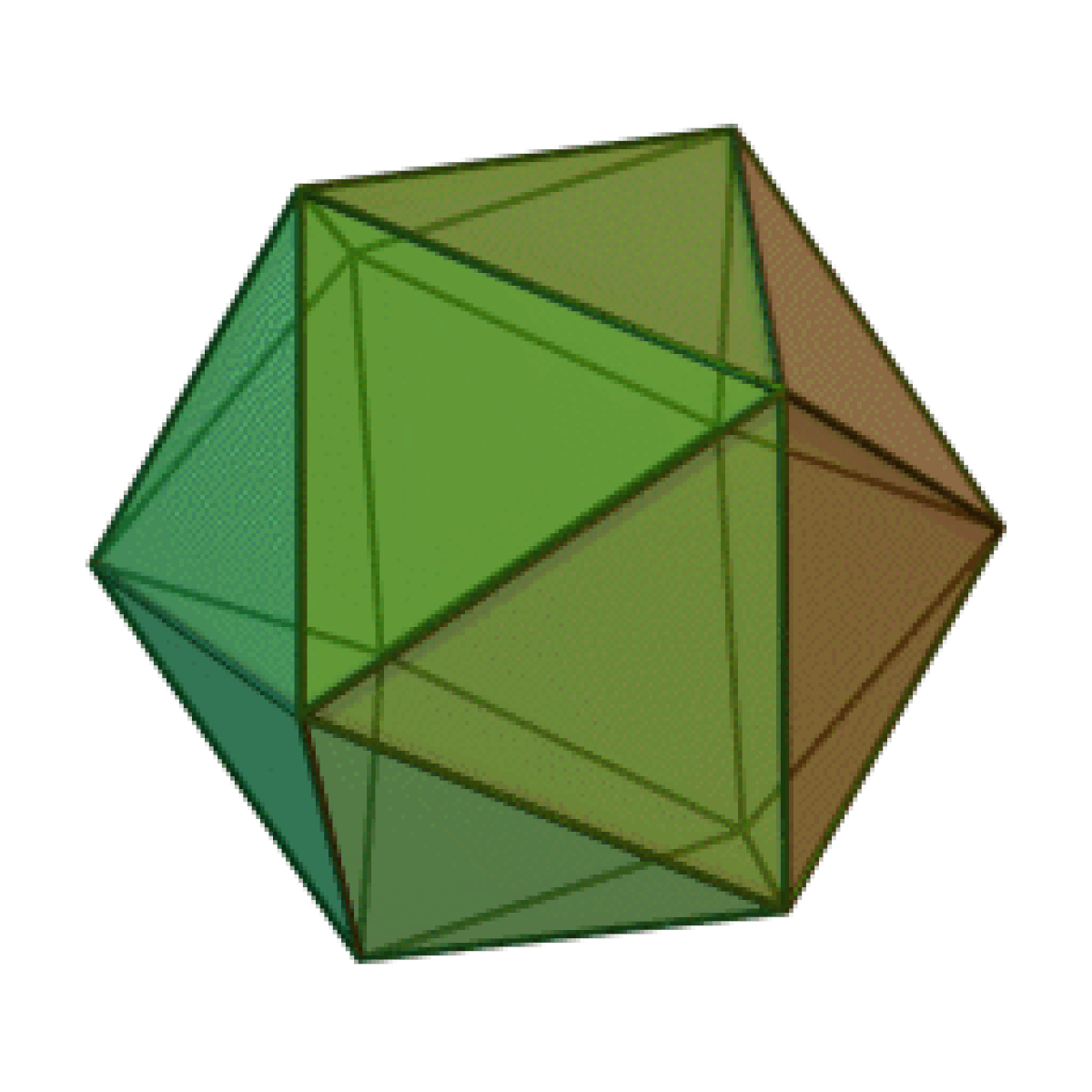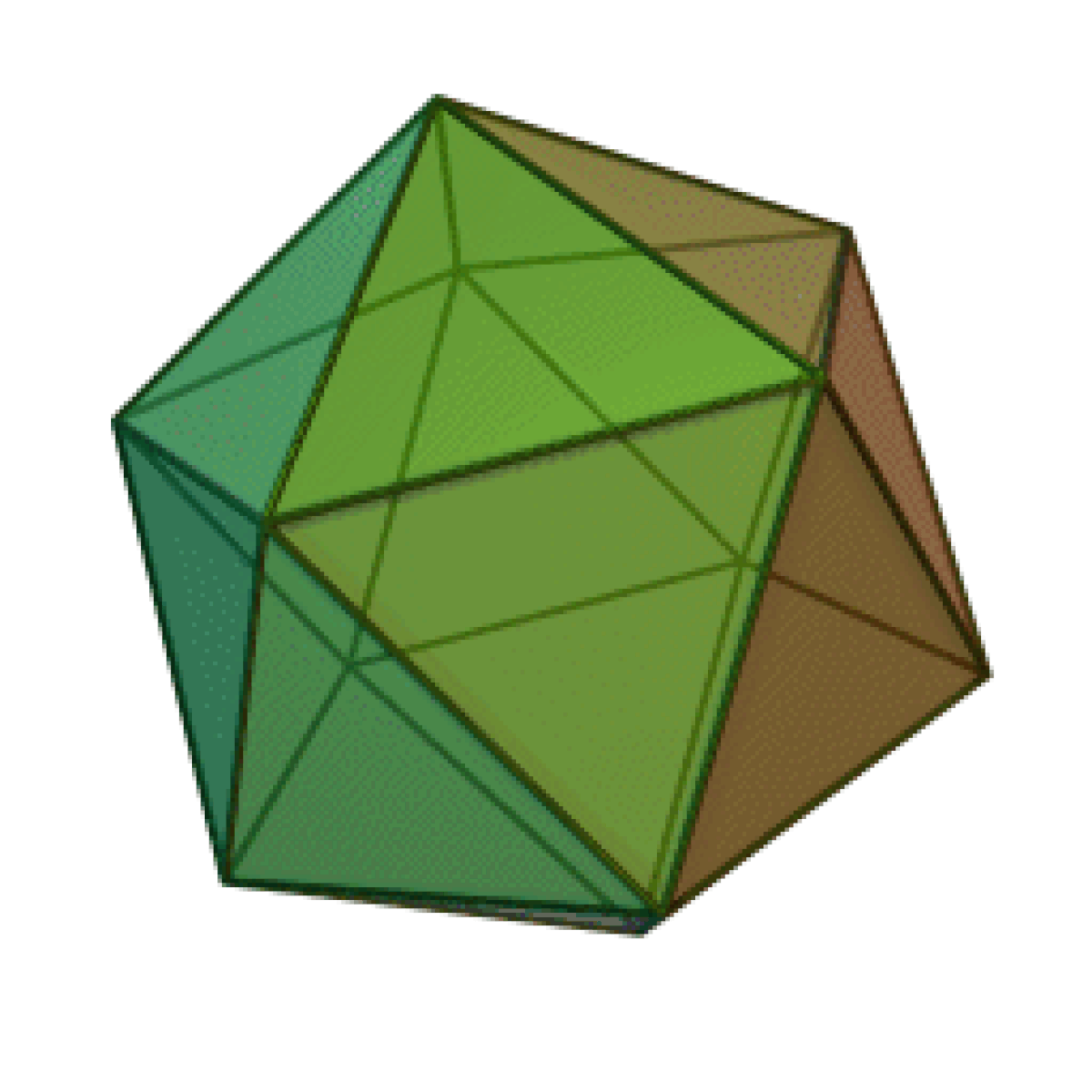 | 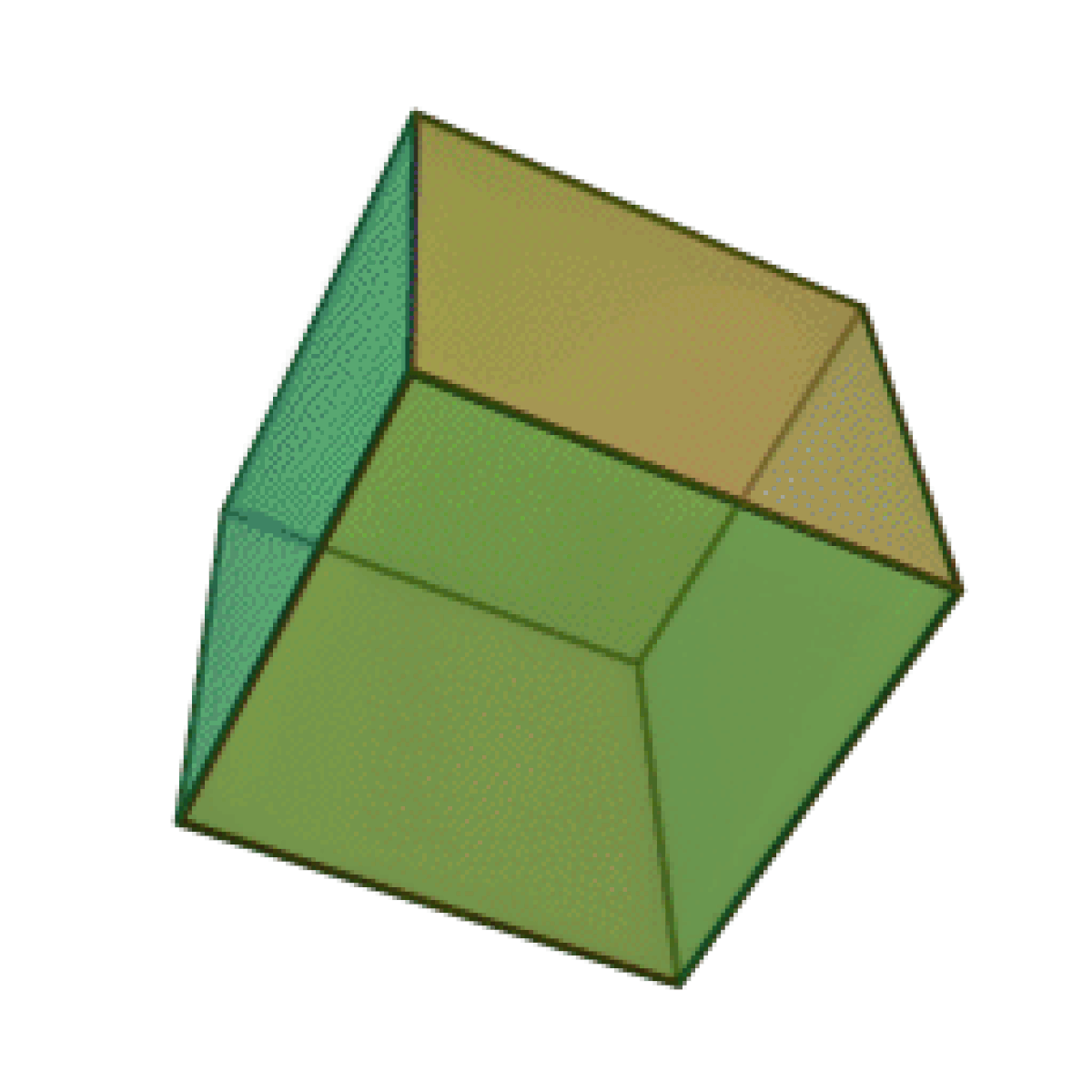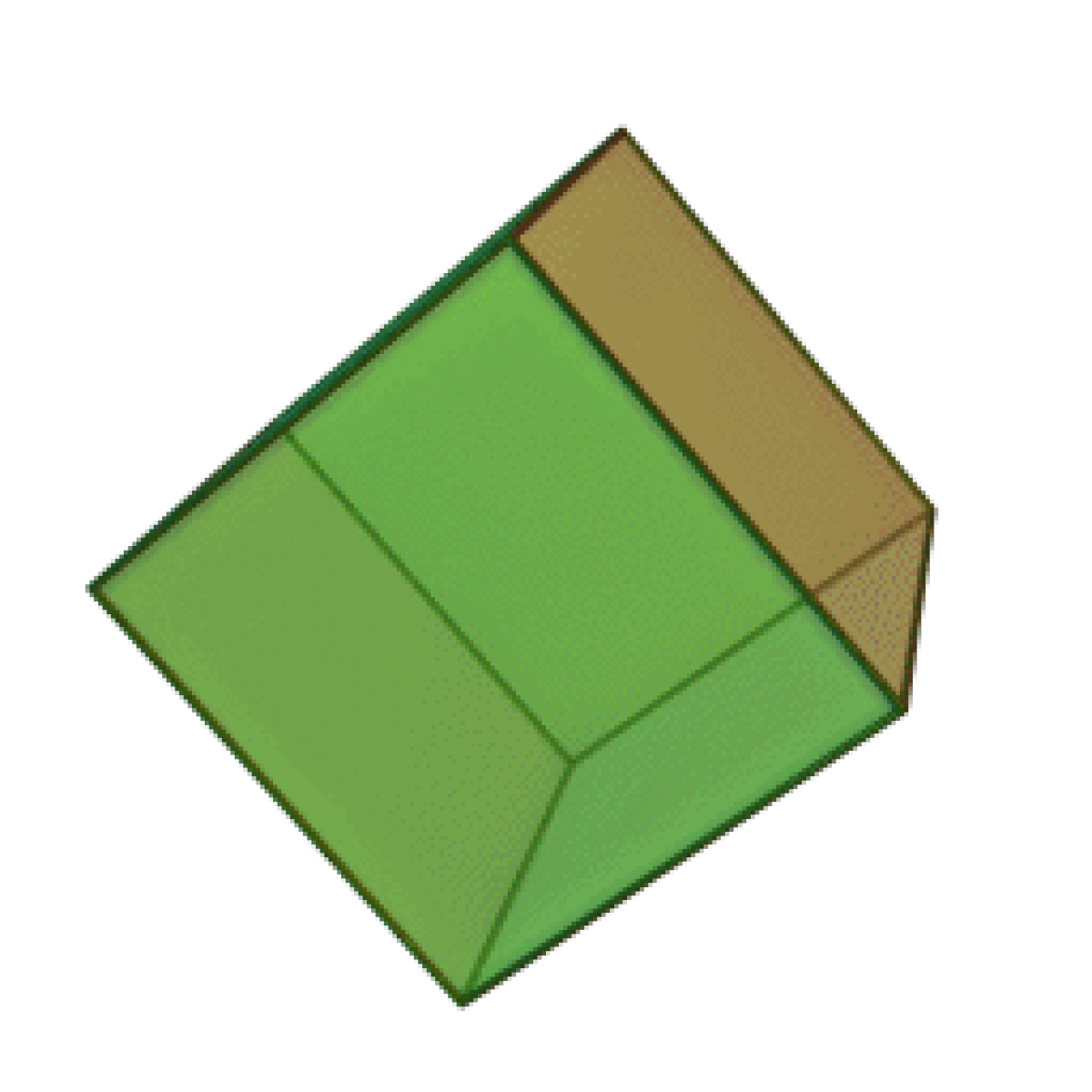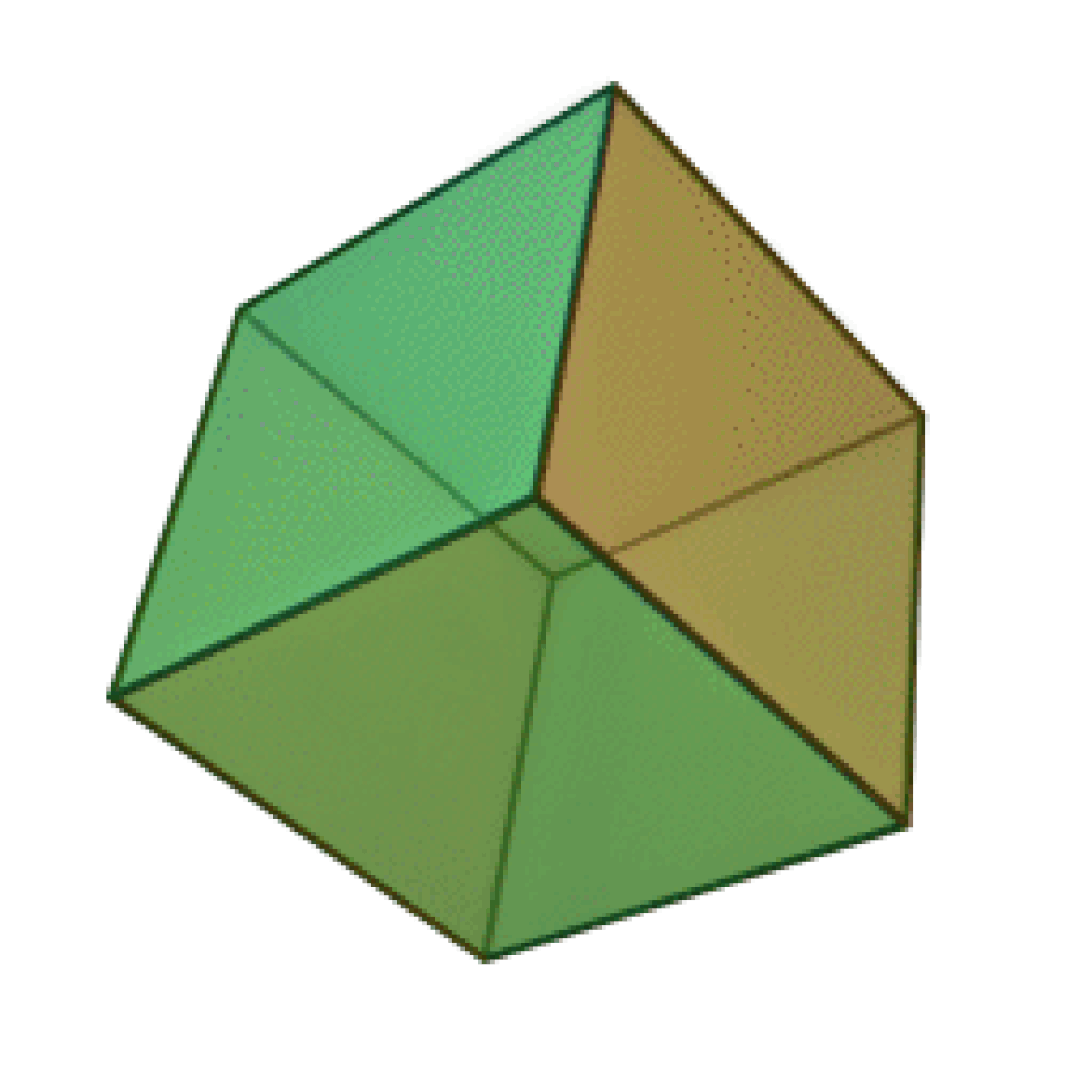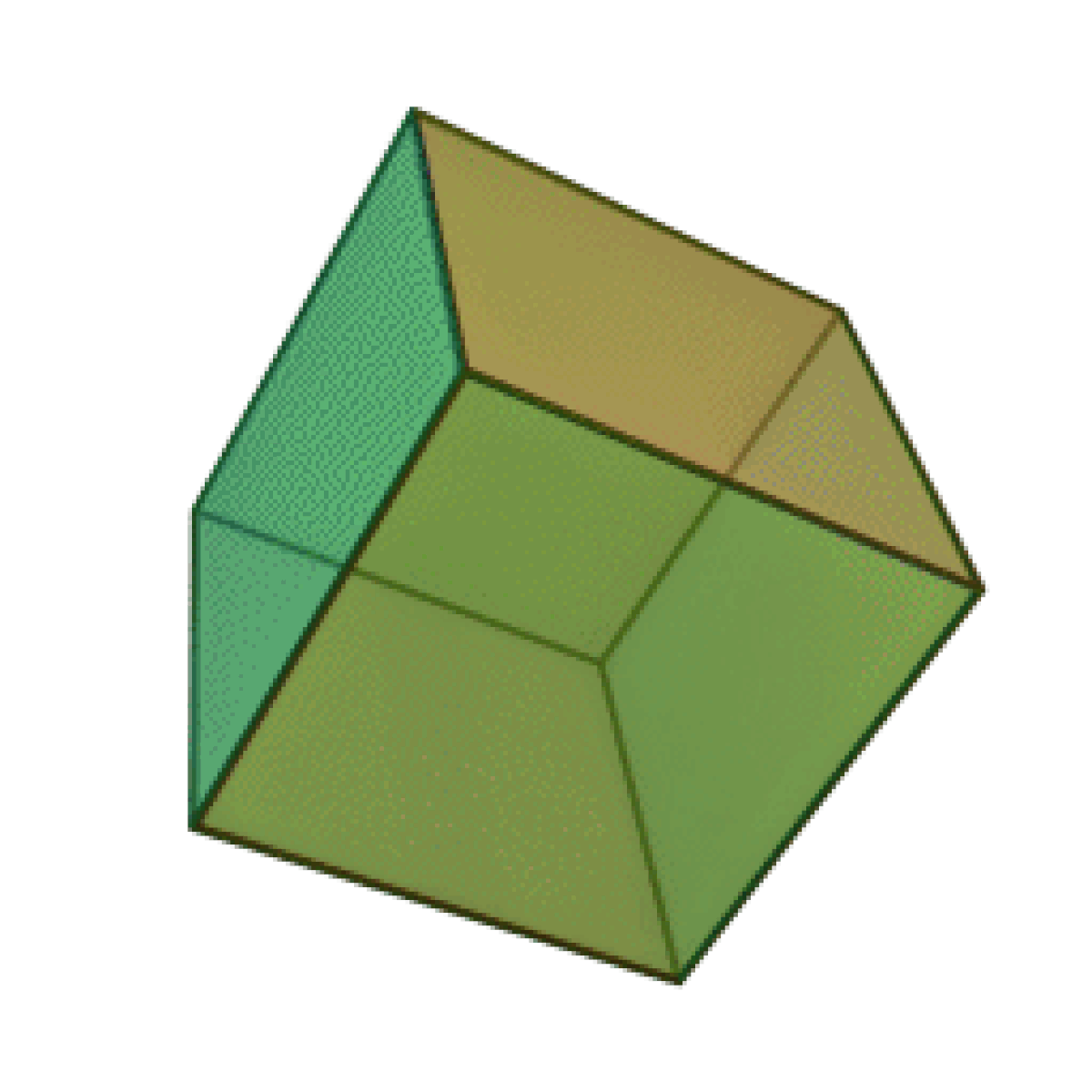 | |
| Tétraèdre (feu) | Octaèdre (air) | Icosaèdre (eau) | Cube (terre) |
À cette théorie des quatre éléments, Aristote ajoute vers 350 av. J.-C., un cinquième élément ou "quintessence", ce qui forme les cieux. Sur base de cette logique, divers auteurs ont spéculé au cours du temps sur des formes géométriques possibles, telles que des cercles, carrés, polygones, etc., des éléments, et comment ces formes pourraient se combiner, se repousser, ou interagir les unes contre les autres pour créer de nouveaux éléments.
XVIIIe siècle
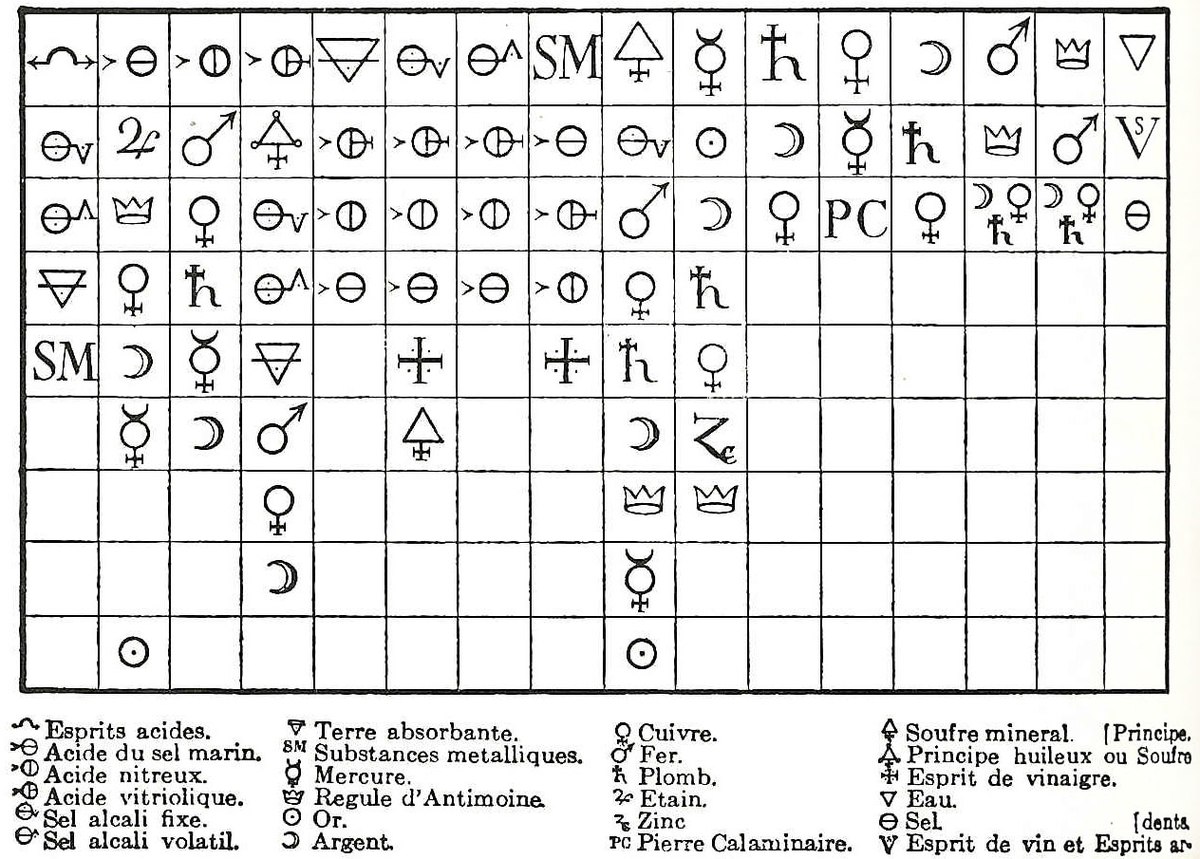
La théorie de la combinaison par affinité chimique est le précurseur de l'idée d'une combinaison d'atomes liés entre eux. Par exemple, en 1718, le Français Étienne-François Geoffroy, en se fondant sur le concept de combinaison de clusters développé par Boyle, développe la théorie des affinités chimiques pour expliquer les combinaisons de particules en estimant qu'une force alchimique assemble certains éléments entre eux. Le nom de Geofroy est mieux connu pour sa table des affinités chimiques (Tables des rapports), présentée à l'Académie française en 1718 et 1720.
Cette table reprenait les résultats obtenus par l'observation de l'action de différentes substances vis-à-vis d'une autre et montrait que des corps analogues présentaient une affinité différente pour différentes réactifs. Ces tables d'affinités resteront à la mode pour le reste du siècle jusqu'à son remplacement par les conceptions de Claude Louis Berthollet.
En 1738, un physicien et mathématicien suisse Daniel Bernoulli publie Hydrofynamica, qui restera le fondement de la théorie cinétique des gaz. Dans ce travail, Bernoulli propose l'argument, encore utilisé de nos jours, qu'un gaz consiste en un grand nombre de molécules se déplaçant dans toutes les directions, que la pression du gaz que l'on peut mesurer est causée par l'impact des molécules sur les surfaces qu'elles rencontrent et que ce que l'on perçoit comme de la chaleur est simplement l'énergie cinétique de leur mouvement. Cette théorie ne fut pas immédiatement acceptée, en partie dû au fait que le principe de la conservation de l'énergie n'avait pas encore été établi et qu'il n'était pas évident pour les physiciens de savoir comment les collisions entre les molécules pourraient être parfaitement élastiques.
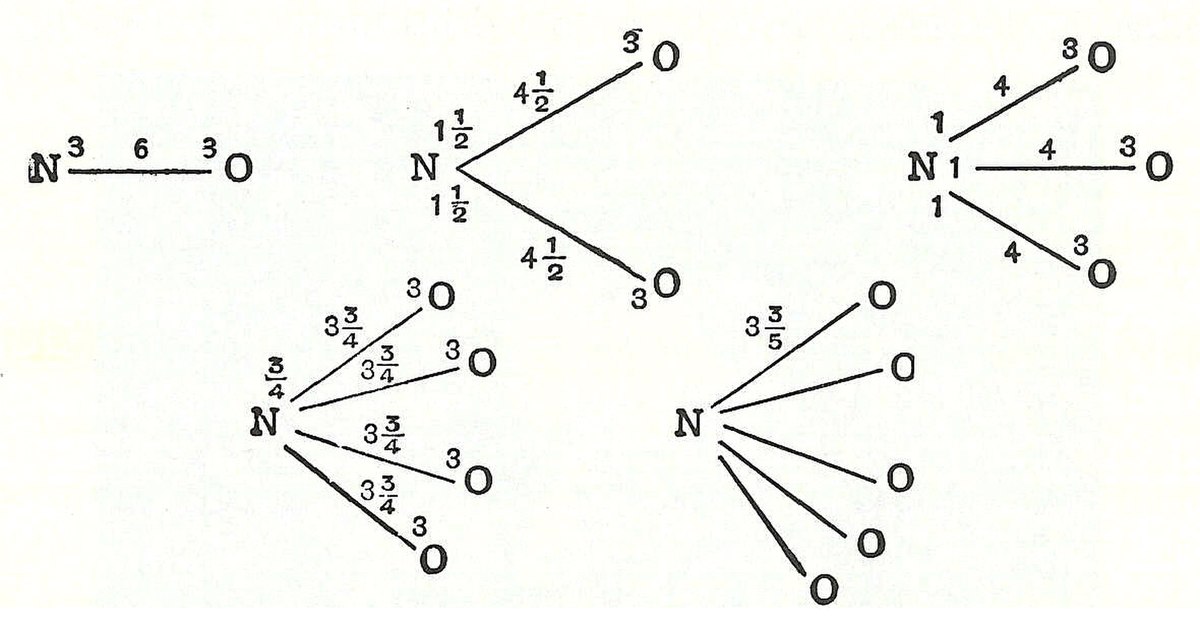
En 1789, William Higgins publie un travail sur ce qu'il appelle les combinaisons de particule « ultime », qui annonce le concept de la liaison de valence. Si, par exemple, selon Higgins, la force entre la particule ultime de l'oxygène et la particule ultime de l'azote est de 6, alors la résistance de la force est divisée en conséquence, et de manière similaire pour les autres combinaisons des particules ultimes :