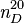Méthanal - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Méthanal | |||||
|---|---|---|---|---|---|
| |||||
| Général | |||||
| Nom IUPAC | |||||
| Synonymes | formaldéhyde aldéhyde formique formol | ||||
| No CAS | |||||
| No EINECS | |||||
| PubChem | |||||
| No E | E240 | ||||
| SMILES | |||||
| InChI | |||||
| Apparence | gaz, d'odeur caractéristique, ou liquide incolore (solution) | ||||
| Propriétés chimiques | |||||
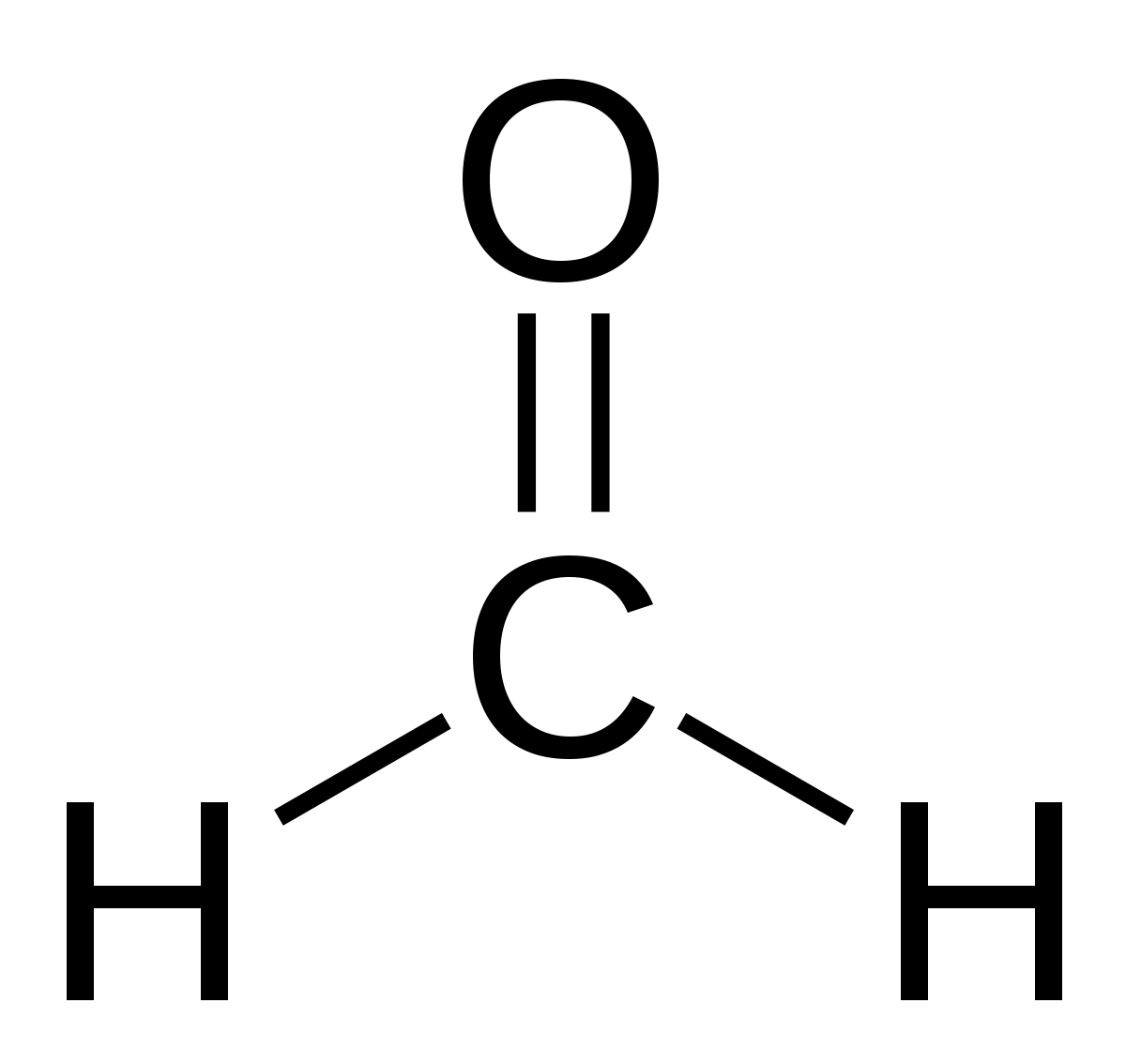
| Formule brute | CH2O | ||||
| Masse molaire | 30,026 ± 0,0012 g·mol-1 | ||||
| pKa | 13,27 à 25 °C | ||||
| Moment dipolaire | 2,332 ± 0,002 D | ||||
| Propriétés physiques | |||||
| T° fusion | -92 °C | ||||
| T° ébullition | -19,5 °C ; 98 °C (solution à 37 %) | ||||
| Solubilité | 4,00.105 mg/L (eau, 20 °C) ; soluble dans l'alcool, l'éther, l'acétone, le benzène | ||||
| Masse volumique | 0,8 g·cm-3 | ||||
| T° d’auto-inflammation | 430 °C | ||||
| Point d’éclair | 53 °C | ||||
| Limites d’explosivité dans l’air | 7–73 %vol | ||||
| Pression de vapeur saturante | 3 890 mmHg (25 °C) | ||||
| Point critique | 137,2 à 141,2 °C 6,784–6,637 MPa | ||||
| Thermochimie | |||||
| S0 | 218,8 J/mol·K | ||||
| ΔH0 | -108,6 kJ/mol | ||||
| Cp | 35,4 J/mol.K | ||||
| Propriétés électroniques | |||||
| 1re énergie d'ionisation | 10,88 ± 0,01 eV (gaz) | ||||
| Propriétés optiques | |||||
| Indice de réfraction |
| ||||
| Spectre d’absorption | absorption max (gaz) : 155,5 nm (LOG E=4,37) ; 175 nm (LOG E=4,26) | ||||
| Précautions | |||||
| | |||||
| |||||
| Phrases R : 23/24/25, 34, 40, 43, | |||||
| Phrases S : 1/2, 26, 36/37/39, 45, 51, | |||||
| | |||||
| |||||
| | |||||



| |||||
| | |||||


Danger | |||||
| | |||||
| Groupe 1 : cancérogène pour l'homme | |||||
| Inhalation | potentiellement létal | ||||
| Yeux | irritant | ||||
| Écotoxicologie | |||||
| DL | 100 mg·kg-1 (rats, oral) 220,1 mg·kg-1 (lapins, dermal) | ||||
| Valeur d'exposition | 0,3 ml/m³ ; 0,37 mg·m-3 | ||||
| LogP | 0,35 | ||||
| | |||||
Le méthanal ou formaldéhyde ou aldéhyde formique ou formol est un composé organique de la famille des aldéhydes, de formule chimique CH2O. C'est d'ailleurs le plus simple des composés de cette famille. À température ambiante, c'est un gaz inflammable.
Il fut synthétisé pour la première fois par le Russe Alexandre Boutlerov en 1859, mais fut formellement identifié par l'Allemand August Wilhelm von Hofmann en 1867. Le terme « formol » est généralement réservé à ses solutions aqueuses.
On trouve du méthanal dans les produits d'une combustion incomplète de substances contenant du carbone. Il y en a dans la fumée des feux de forêt, dans les rejets des automobiles, et dans la fumée du tabac. Le méthanal est aussi produit dans l'atmosphère sous l'action des rayons solaires et du dioxygène sur le méthane atmosphérique ainsi que sur d'autres hydrocarbures. De petites quantités de méthanal sont produites par le métabolisme de la plupart des organismes, dont l'organisme humain.