Oxyde de lithium - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
| Oxyde de lithium | ||
|---|---|---|
| ||
| Général | ||
| No CAS | ||
| No EINECS | ||
| Apparence | poudre | |
| Propriétés chimiques | ||
| Formule brute | Li2O | |
| Masse molaire | 29,881 ± 0,004 g·mol-1 | |
| Propriétés physiques | ||
| T° fusion | 1 570 °C | |
| Solubilité | Hydrolyse violente en LiOH | |
| Masse volumique | 2 013 kg·m-3 | |
| Cristallographie | ||
| symbole de Pearson | cF12 | |
| Classe cristalline ou groupe d’espace | Fm3m (n°225) | |
| Strukturbericht | C1 | |
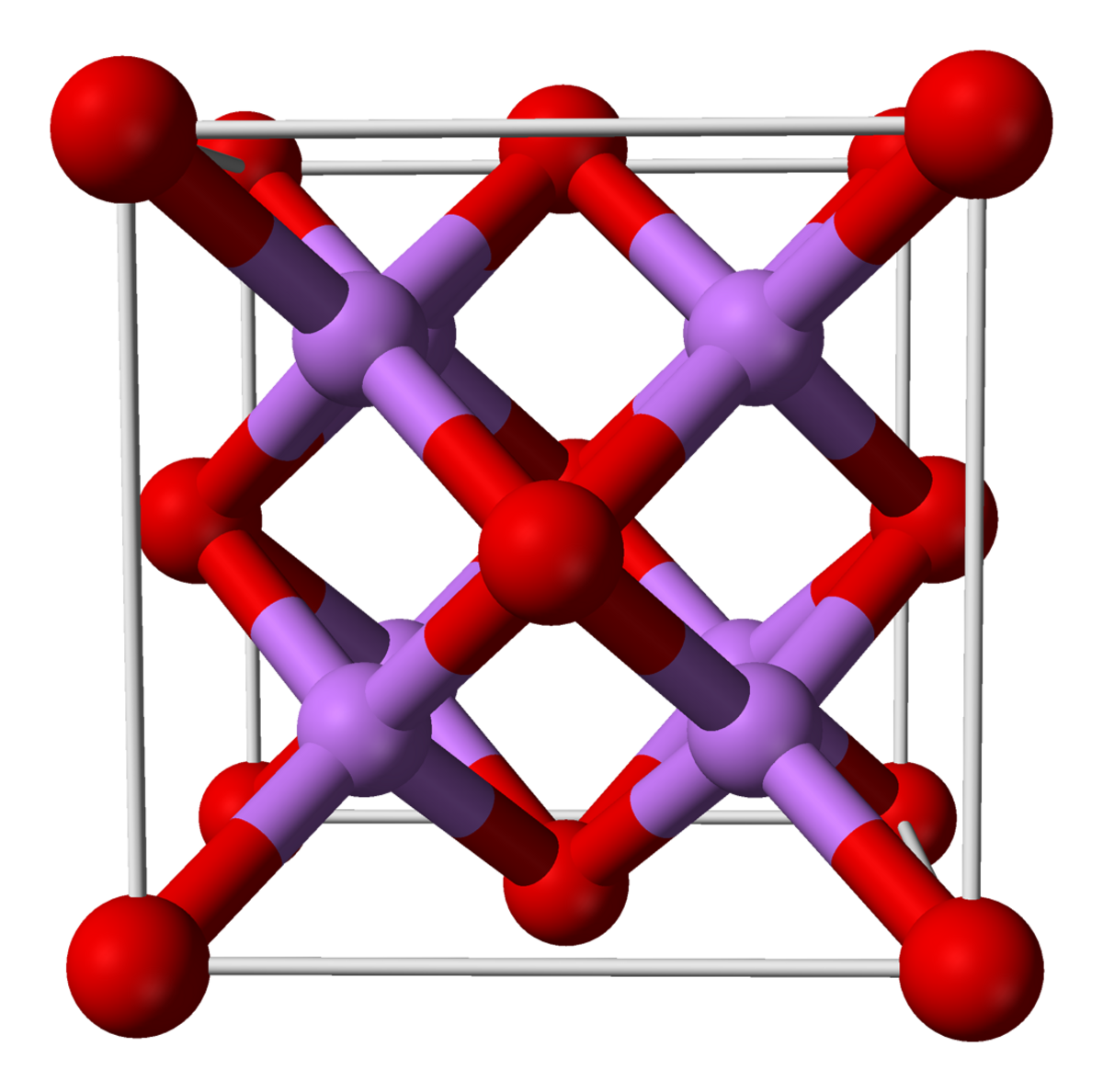
| Structure type | CaF2 | |
| Précautions | ||
| | ||
| ||
| Phrases R : 34, | ||
| Phrases S : 26, 36/37/39, 45, | ||
| | ||

| ||
| | ||
L'oxyde de lithium est un composé chimique de formule LiO. Il se forme avec de petites quantités d'hydroxyde de lithium LiOH lorsque le lithium métallique brûle dans l'air et se combine avec l'oxygène et l'eau atmosphériques :
- 4 Li + O → 2 LiO
- 4 Li + 2 HO + O → 4 LiOH
L'oxyde de lithium présente à l'état solide une structure cristalline calquée sur celle du fluorure de calcium CaF. A l'état gazeux fondamental, la molécule LiO est linéaire, contrairement aux résultats prévus par la théorie VSEPR (d'après laquelle la molécule LiO devrait avoir la même forme que la molécule d'HO), ce qui est cohérent avec une géométrie gouvernée par les liaisons ioniques.
LiO résulte de la décomposition thermique du peroxyde de lithium LiO et attaque la silice à température élevée.


















































