Pyrimidine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Pyrimidine | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | 1,3-diazine | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule brute | C4H4N2 | ||
| Masse molaire | 80,088 ± 0,0039 g·mol-1 80.08796 | ||
| pKa | 1,2 | ||
| Moment dipolaire | 2,334 ± 0,010 D | ||
| Diamètre moléculaire | 0,529 nm | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,23 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| | |||
| Produit non contrôlé | |||
| | |||
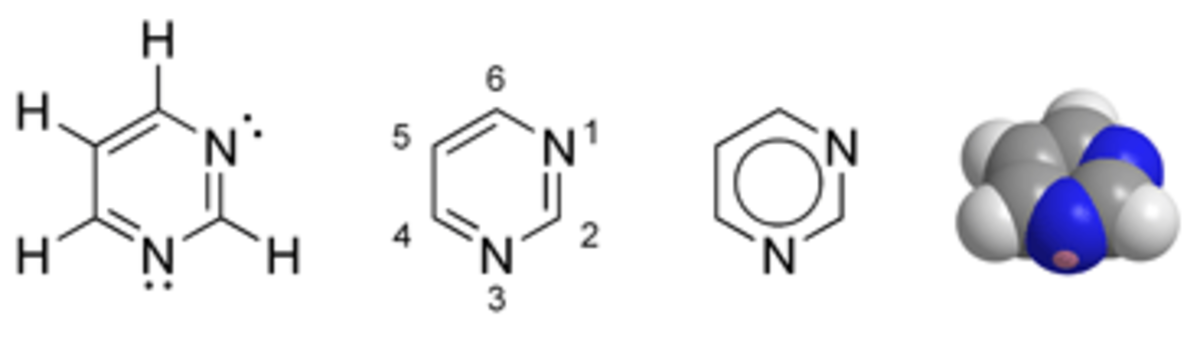
La pyrimidine (ou 1,3-diazine) est une molécule azotée hétérocyclique aromatique (C4H4N2) voisine de la pyridine et comportant deux atomes d'azote. Elle est aussi isomère de position de la pyridazine (1,2-diazine) et la pyrazine (1,4-diazine). Dans un sens plus large, ses dérivés à bases pyrimidiques sont aussi appelés pyrimidines. Ils se retrouvent notamment dans les bases azotées constituant les molécules d'ADN et d'ARN : cytosine, thymine, uracile.
Dans l'ADN ces bases forment des liaisons hydrogènes avec leurs purines complémentaires :
| purine | pyrimidine |
|---|---|
| A | T |
| G | C |
Dans l'ARN, le complément de A (adénine) est l'uracile au lieu de la thymine :
| purine | pyrimidine |
|---|---|
| A | U |
| G | C |
Synthèse des pyrimidines
La plupart des organismes vivants sont capables de synthétiser naturellement des pyrimidines. On ne connaît actuellement qu'une voie de biosynthèse commune ; cette voie part de l'aspartate qui est transformé par trois réactions consécutives en orotate (elle-même une pyrimidine), qui devient ensuite de l'UMP après deux réactions supplémentaires. Les autres nucléotides pyrimidiques peuvent ensuite être créés à partir de l'UMP.
Chez l'homme, la synthèse des pyrimidines se produit dans le cytoplasme des cellules, et plus particulièrement dans celles du foie, voire dans les cellules du cerveau mais dans une moindre mesure. Cette voie de biosynthèse est la cible de nombreux inhibiteurs pharmacologiques.
Les pyrimidines peuvent être obtenues synthétiquement par réaction entre un dérivé β-dicarbonylé (ex. : β-dicétone) et une amidine (ou un composé similaire tel l'urée, la thiourée ou la guanidine) à l'aide de catalyse acide ou basique si les combinaisons de nucléophile-électrophile ne sont pas assez réactives. Certaines de ces combinaisons peuvent conduire à la formation de pyrimidones, analogues des pyridones.
Une voie de synthèse intéressante des méthylpyrimidines est l'addition de l'amidure de sodium sur la 2-bromopyridine. Alors que les conditions sont similaires à la réaction de Chichibabin, on a addition en position 4, ouverture de cycle avec élimination du bromure, réarrangement et fermeture de cycle pour donner la 4-méthylpyrimidine, avec un rendement de 80%. Appliquée à la 2-bromopyrimidine, cette réaction mène à une 1,3,5-triazine. Cependant, la 2,6-dibromopyridine, traitée dans les mêmes conditions, ne donne pas de triazine comme l'on pourrait l'imaginer mais à un diazole, par contraction de cycle.