Amidure de sodium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Amidure de sodium | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| Apparence | poudre grisâtre, incolore quand elle est pure | ||
| Propriétés chimiques | |||
| Formule brute | H2NNa | ||
| Masse molaire | 39,0123 ± 0,0003 g·mol-1 | ||
| pKa | 38 | ||
| Propriétés physiques | |||
| T° fusion | 210 °C | ||
| T° ébullition | 400 °C | ||
| Solubilité | soluble dans l'ammoniac, réagit avec l'eau | ||
| Masse volumique | 1,39 g·cm-3 | ||
| T° d’auto-inflammation | 450 °C | ||
| Point d’éclair | 4,44 °C | ||
| Cristallographie | |||
| Structure type | orthogonal | ||
| Précautions | |||
| | |||
| |||
| | |||
|
2 3 3 | |||
| | |||
L'amidure de sodium est le composé chimique de formule semi-développée NaNH2. Ce composé qui réagit violemment avec l'eau, est blanc quand il est pur mais dans le commerce, il est typiquement gris ce qui est dû à la présence d'une petite quantité de fer métallique issue du processus de préparation. De telles impuretés n'affectent généralement pas la réactivité de l'amidure de sodium. NaNH2 est très largement employé en synthèse organique comme base forte.
Préparation et structure
L'amidure de sodium peut être préparé par la réaction du sodium sur l'ammoniac gazeux (NH3) mais généralement la réaction dans ammoniac liquide en utilisant du nitrate de fer(III) comme catalyseur est préférée. En effet, cette réaction est plus rapide au point d'ébullition de l'ammoniac, c'est-à-dire -33 °C :
- 2 Na + 2 NH3 → 2 NaNH2 + H2
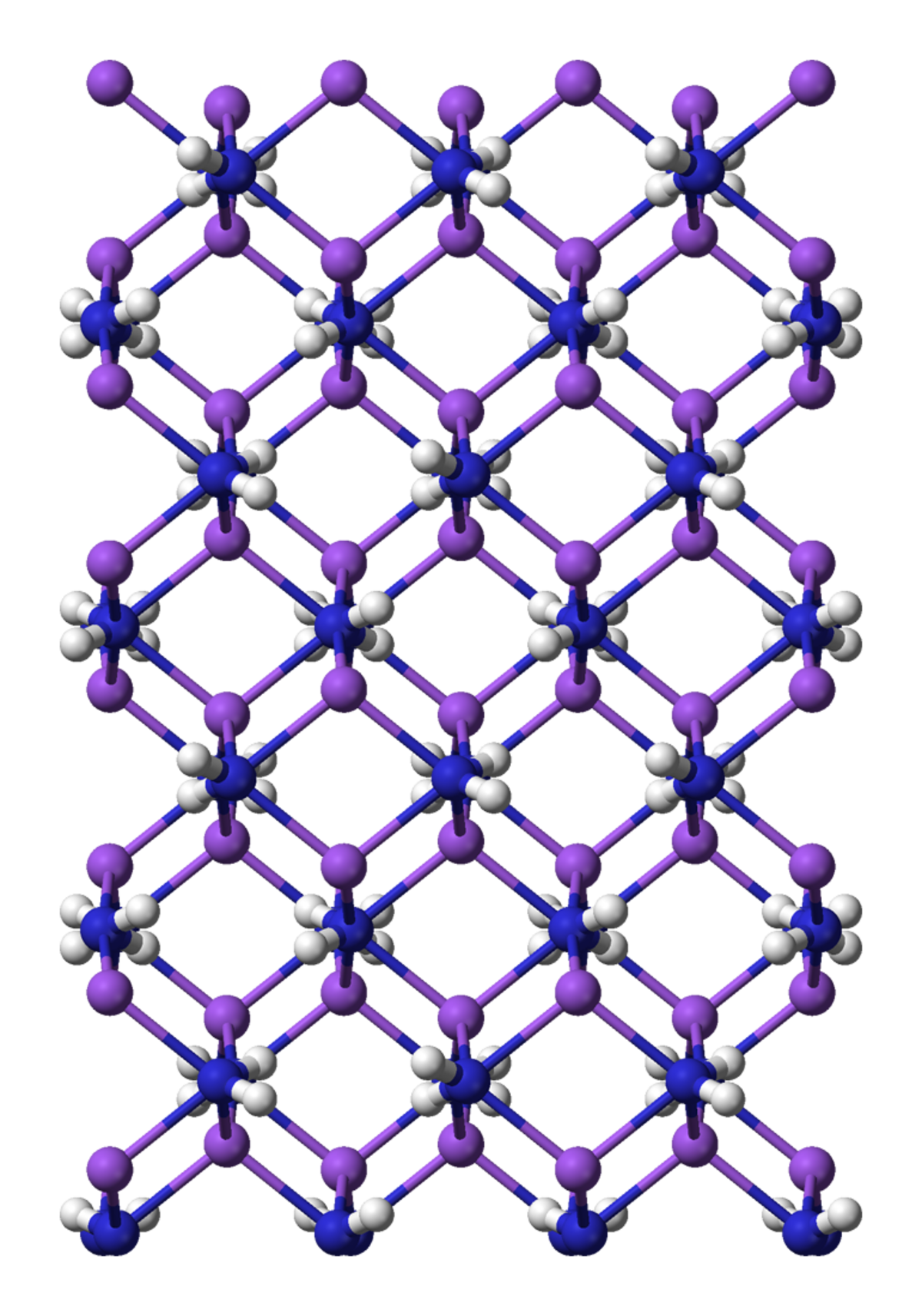
NaNH2 est un composé plutôt ionique et comme tel cristallise en un polymère tridimensionnel et infini. La géométrie autour des atomes de sodium est tétraédrique. Dans l'ammoniac, l'amide de sodium forme des solutions conductrices, ce qui s'explique par la présence des ions Na(NH3)6+ et des anions NH2-.
Sécurité
L'amidure de sodium réagit violemment avec l'eau pour produire de l'ammoniac et de l'hydroxyde de sodium et brûle dans l'air en donnant des oxydes de sodium et d'azote :
- NaNH2 + H2O → NH3 + NaOH
- 2NaNH2 + 4O2 → Na2O2 + 2NO2 + 2H2O
Dans le cas d'une quantité limitée d'air et d'humidité, comme par exemple dans un conteneur mal fermé, un mélange explosif de produits d'oxydation, caractérisé par un jaunissement ou un brunissement du solide, peut se former. Ainsi l'amidure de sodium doit toujours être conservé dans des conteneurs scrupuleusement fermés et si possible, sous azote. Les parts d'amidure de sodium qui sont de couleur jaune à marron doivent être détruits immédiatement. Une méthode de destruction est d'additionner précautionneusement de l'éthanol à une suspension de cet amidure de sodium dans un solvant hydrocarbure.
L'amidure de sodium est soupçonnée d'être corrosif sur la peau, les yeux et les muqueuses. Des précautions doivent être prises pour empêcher la dispersion de poussière d'amidure de sodium.




















































