Transfert d'énergie entre molécules fluorescentes - Définition
La liste des auteurs de cet article est disponible ici.
Utilisation de la GFP et de ses dérivés en FRET
L’innovation probablement la plus importante dans le domaine des fluorophores fut marquée par la découverte d’une protéine fluorescente pouvant être directement encodée à l’intérieur de la cellule. Il s’agit de la GFP (Green Fluorescent Protein). L’exploitation de la GFP et la génération de variants de cette protéine ont permis le développement de technologies de FRET parfaitement adaptées à l’étude de la dynamique des interactions moléculaires dans l’espace et dans le temps à l’intérieur de cellules vivantes.
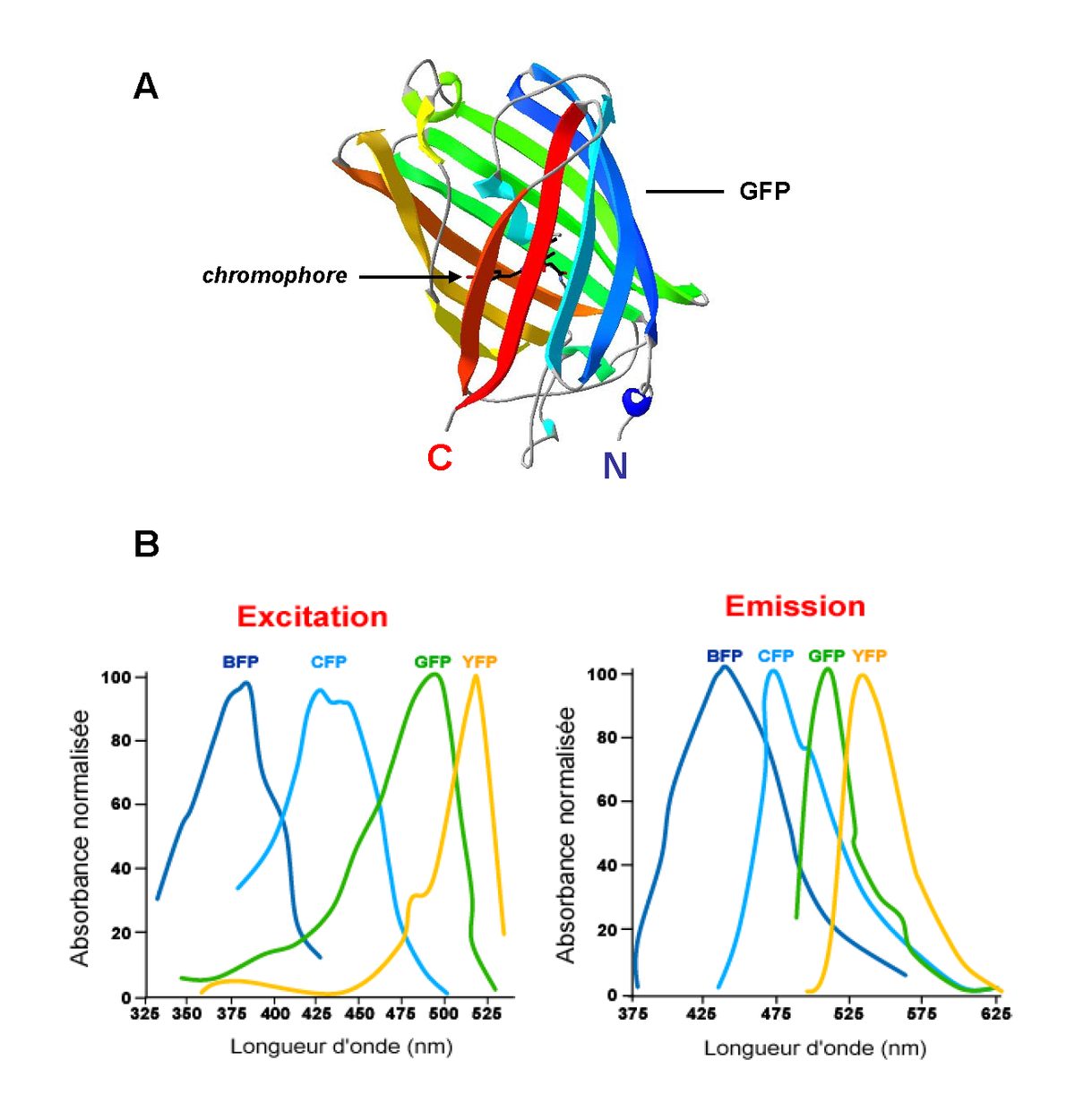
Initialement identifié chez la méduse Aequorea Victoria, le gène codant la GFP a été cloné en 1992 par Prasher et coll. Cristallisée pour la première fois en 1974, il faudra attendre 1996 pour obtenir la structure tridimensionnelle de la GFP par diffraction de rayons X (Ormo et al., 1996). Cette protéine de 27 kDa se présente sous forme d’un cylindre de 30 Å (Ångström) de diamètre et 40 Å de hauteur composé de onze feuillets β (9 à 13 résidus par feuillet) qui entourent une hélice α contenant le chromophore (Figure 2.A). Le chromophore résulte d'une réaction spontanée de cyclisation des chaînes latérales de trois acides aminés (Sérine65 – Tyrosine66 – Glycine67) à l’intérieur du tonneau. L’organisation des feuillets β en formant une véritable cage, confère au chromophore son propre environnement (Ward, 2006).
La photoactivation de cette protéine dont le pic d’absorption majoritaire est à 395 nm entraîne une réaction autocatalytique provoquant l’émission d’une lumière verte avec un pic d’émission à 508 nm. Différentes protéines mutantes de la GFP ont été produites. En changeant, entre autres, la structure des trois acides aminés formant le chromophore, il a été possible de modifier les longueurs d'onde d'absorption et d'émission de la GFP devenant alors, une BFP (Blue Fluorescent Protein), une YFP (Yellow Fluorescent Protein) ou de nombreux autres variants bien caractérisés (CFP, RFP…) (Figure 2.B). L’utilisation de ces différents mutants comme sondes moléculaires en font des outils de choix aussi bien dans l’étude de l’expression de gènes, le suivi de protéines et leur compartimentalisation cellulaire que dans l’analyse des interactions protéine – protéine par des approches de transfert d’énergie. Concernant ce dernier point, deux paires de fluorophores ont été largement utilisées. Ces molécules BFP/GFP et CFP/YFP dérivées de la GFP présentent en effet des propriétés photophysiques compatibles avec la mise en place d’un transfert d’énergie.
Le point fort de cette technologie réside dans l’encodage des protéines fluorescentes. Il est donc possible de suivre en microscopie la localisation cellulaire des protéines avec une bonne résolution spatiale. De plus, grâce à la forte intensité de fluorescence des molécules utilisées, les phénomènes de transfert d’énergie peuvent être visualisés directement dans la cellule permettant de définir à la fois la nature des protéines en interactions, la dynamique de ces phénomènes et leur localisation cellulaire.
Dans le domaine des récepteurs couplés aux protéines G (RCPG) cette approche a été beaucoup utilisée pour caractériser la dimérisation des récepteurs (association par paire des protéines formant un récepteur fonctionnel). La fusion des GFP au niveau de la région carboxy-terminale des récepteurs a permis d’analyser leur organisation sans pour autant altérer leur structure, fonction ou localisation dans les travaux publiés. Le principal inconvénient de cette approche pour l’étude de la dimérisation vient de la nécessité de passer par la microscopie confocale. En effet, en microscopie classique par épifluorescence ou dans un fluorimètre il n’est pas possible de séparer le signal provenant des récepteurs de surface de celui des récepteurs retenus dans les compartiments intracellulaires. De plus, la difficulté de miniaturisation de cette approche en microplaque ne permet pas d’étendre ce type d’analyse à du moyen ou haut débit.