Transfert d'énergie entre molécules fluorescentes - Définition
La liste des auteurs de cet article est disponible ici.
Utilisation du BRET (Bioluminescence Resonance Energy Transfer)
Voir l'article sur le BRET
Exemples d'application du FRET
Transfert d’énergie intermoléculaire
Les techniques de transfert d’énergie, FRET (variants de la GFP, anticorps marqués…) ou BRET, ont été beaucoup utilisées pour démontrer des interactions protéines – protéines aussi bien à l’intérieur de la cellule qu’à la surface cellulaire. Quelle que soit la méthode choisie, cette démonstration repose sur la détection d’un signal caractéristique reflétant la forte proximité, si ce n’est l’association, des protéines cibles. Dans le domaine des récepteurs couplés aux protéines G, ces approches ont révélé l’existence de récepteurs membranaires homo- ou hétérodimériques et ont contribué à mieux comprendre les mécanismes intervenant au cours de l’activation des protéines G. Elles ont aussi permis de développer, entre autres, des sondes sensibles à des seconds messagers comme par exemple l’AMPc (Zaccolo et al., 2000). En effet, l’AMPc en se fixant au niveau des sous-unités catalytiques et régulatrices de la PKA, entraîne une dissociation de ce complexe. Ainsi, en fusionnant les fluorophores au niveau des différentes sous-unités, il est possible de corréler directement la production d’AMPc intracellulaire à une diminution du signal de FRET.
Transfert d’énergie intramoléculaire (changements conformationnels)
Les techniques de transfert d’énergie sont des approches suffisamment sensibles pour mesurer des changements conformationnels intervenant au sein d’une protéine. Ceci est possible en incorporant les fluorophores donneur et accepteur à différentes positions de la protéine d’intérêt. Les points d’insertion sont choisis de manière à ce que les changements conformationnels, en modifiant la distance et/ou l’orientation des fluorophores, entraînent des modifications du transfert d’énergie (augmentation ou diminution).
Le transfert d’énergie intramoléculaire a permis d’analyser les changements conformationnels intervenant au cours des processus d’activation des récepteurs membranaires. Ainsi, Vilardaga et coll. ont analysé les réarrangements intracellulaires induits par la fixation de molécules agonistes et antagonistes au niveau des récepteurs béta-2A-adrénergiques et des récepteurs aux hormones parathyroïdiennes (Vilardaga et al., 2003). Le même type d’analyse a permis d’étudier les changements conformationnels du récepteur aux androgènes (Schaufele et al., 2005).
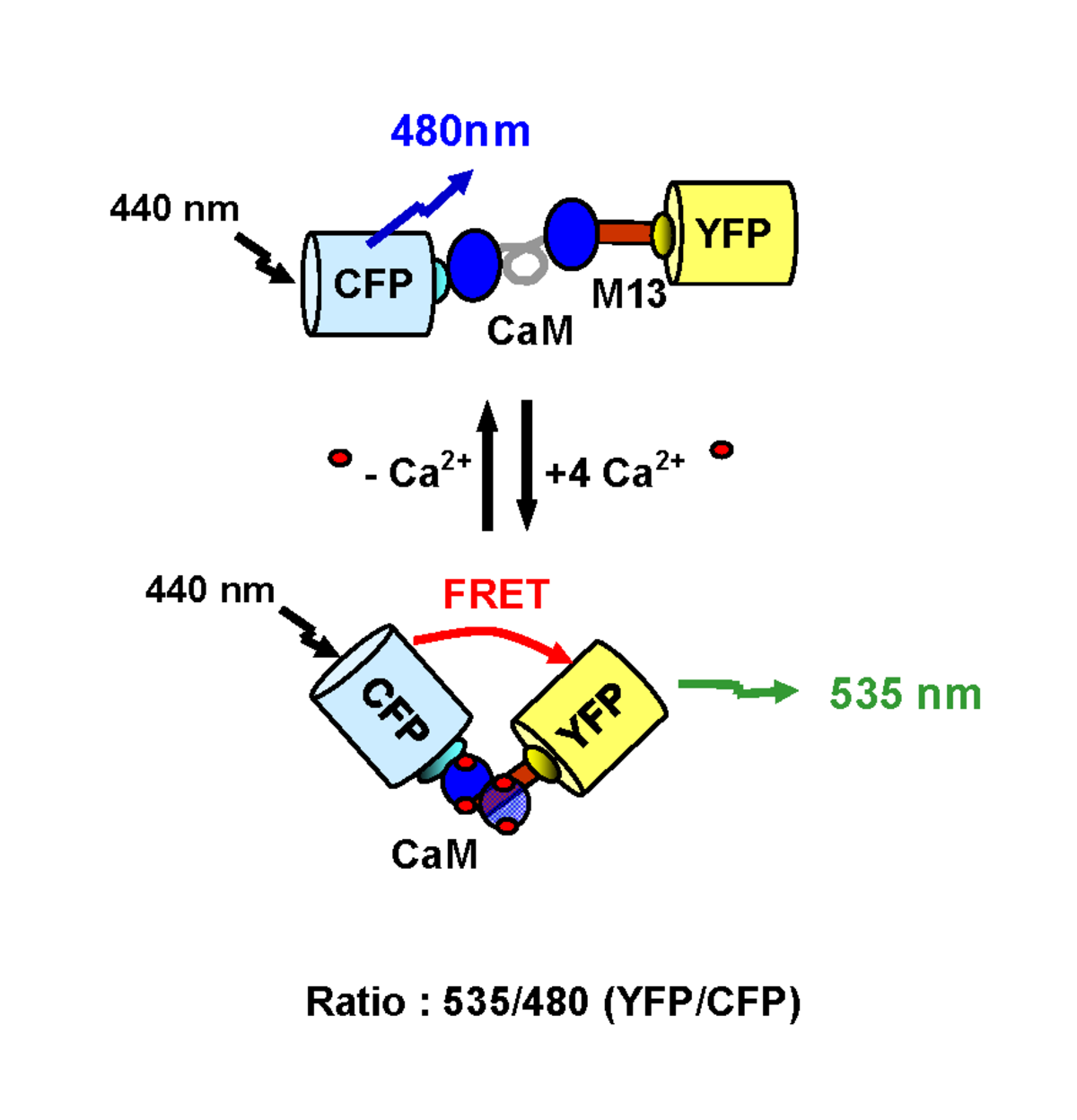
De nombreuses sondes intracellulaires ont aussi été développées sur ce principe. L’objectif de ces systèmes est de pouvoir révéler l’activation d’une voie de signalisation particulière en mesurant les variations de concentrations de différents seconds messagers. La première sonde fluorescente appelée caméléon, a été développée par Miyawaki et coll. afin de mesurer les modifications de la concentration calcique à l’intérieur de la cellule (Miyawaki et al., 1997) (Figure). Suite à la fixation de quatre ions calcium au niveau de son domaine calmoduline, la sonde subit des changements conformationnels provoquant un rapprochement des fluorophores. L’augmentation du signal de FRET à 510 (GFP) ou 535 nm (YFP) est dépendante de la production calcique intracellulaire. Il est ainsi possible de mesurer en temps réel, les variations de la concentration calcique à l’intérieur de la cellule. D’autres sondes ont aussi été développées pour mesurer notamment la concentration en GMPc (Nikolaev et al., 2006) ou pour détecter simultanément l’activité de la PKA et de la PKC (Brumbaugh et al., 2006).