1-bromobutane - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| 1-bromobutane | ||||
|---|---|---|---|---|
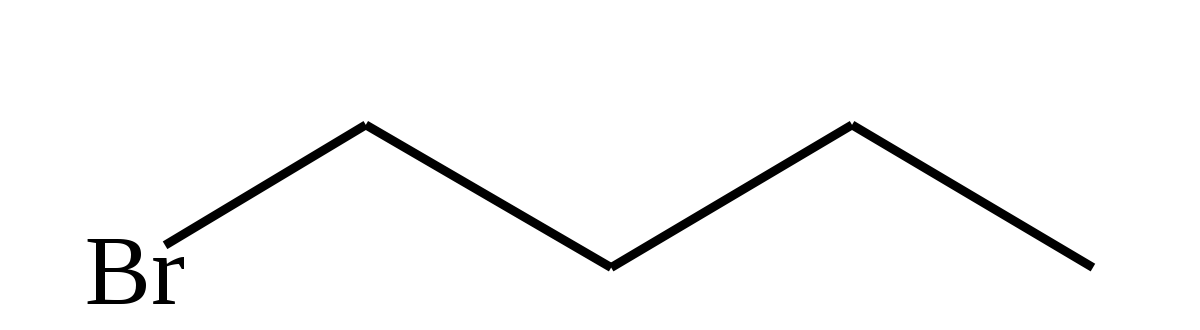
| ||||
| Général | ||||
| Nom IUPAC | ||||
| No CAS | ||||
| No EINECS | ||||
| SMILES | ||||
| InChI | ||||
| Propriétés chimiques | ||||
| Formule brute | C4H9Br | |||
| Masse molaire | 137,018 ± 0,005 g·mol-1 | |||
| Moment dipolaire | 2,08 ± 0,10 D | |||
| Diamètre moléculaire | 0,566 nm | |||
| Propriétés physiques | ||||
| T° fusion | -112,4 °C | |||
| T° ébullition | 102 °C | |||
| Solubilité | presque insoluble dans l'eau (0,6 g·l-1), soluble dans l'éthanol, l'éther | |||
| Masse volumique | 1,2686 g·cm-3 à 20 °C | |||
| T° d’auto-inflammation | 265 °C | |||
| Point d’éclair | 13 °C | |||
| Limites d’explosivité dans l’air | 2,6–6,6 %vol | |||
| Pression de vapeur saturante | 43 mbar à 20 °C 68 mbar à 30 °C 175 mbar à 50 °C | |||
| Thermochimie | ||||
| Cp | ||||
| Propriétés optiques | ||||
| Indice de réfraction |
| |||
| Précautions | ||||
| | ||||
| ||||
| Phrases R : 11, 36/37/38, 51/53, | ||||
| Phrases S : 16, 26, 61, | ||||
| | ||||
| ||||
| | ||||
|
3 1 0 | ||||
| | ||||

| ||||
| Composés apparentés | ||||
| Isomère(s) | 2-Bromobutane | |||
| Autres composés | 1-Chlorobutane 1-Iodobutane | |||
| | ||||
Le 1-bromobutane (CH3CH2CH2CH2Br) est un dérivé halogéné du butane, ou l'un des atomes d'hydrogène (fixé sur un atome de carbone primaire) a été substitué par un atome de brome. C'est un halogénure d'alkyle primaire.
En conditions normales, il se présente sous la forme d'un liquide incolore, insoluble dans l'eau, mais soluble dans l'éthanol et l'éther.
Production et synthèse
Le 1-bromobutane peut être synthétisé par substitution nucléophile du butan-1-ol par l'acide bromique, le tribromure de phosphore ou encore le bromure de sodium.
Sécurité
Les vapeurs de 1-bromobutane peuvent former avec l'air un mélange explosif (point d'éclair 13 °C, température d'auto-inflammation 265 °C). Il convient donc de le conserver à l'abri de l'air.
Utilisation
En tant qu'halogénure d'alkyle primaire, le 1-bromobutane réagit spécifiquement par des réactions de type SN2. Il est couramment utilisé comme réactif pour des réactions d'alkylation, ou transformé en organomagnésien par réaction avec le magnésium dans l'éther pour former des liaisons carbone-carbone.
Le 1-Bromobutane peut aussi être utilisé pour synthétiser d'autre composés organométalliques, comme le n-butyllithium:
- 2 Li + C4H9Br → C4H9Li + LiBr
Le lithium utilisé pour cette réaction contient en général entre 1 et 3% de sodium. Lorsque le bromobutane est utilisé comme réactif, le produit final est une solution homogène, constituée de clusters mélant bromure de lithium (LiBr) et butyllithium (LiBu).






















































