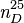Acide trifluoroacétique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide trifluoroacétique | ||
|---|---|---|

| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | Acide perfluoroacétique Acide trifluoroéthanoïque TFA | |
| No CAS | ||
| No EINECS | ||
| No RTECS | ||
| SMILES | ||
| Apparence | liquide incolore | |
| Propriétés chimiques | ||
| Formule brute | C2HF3O2 | |
| Masse molaire | 114,0233 ± 0,0023 g·mol-1 | |
| pKa | 0,3 | |
| Moment dipolaire | 2,28 ± 0,25 D | |
| Diamètre moléculaire | 0,492 nm | |
| Propriétés physiques | ||
| T° fusion | 257,8 K (-15,4 °C) sous 1 bar | |
| T° ébullition | 345,6 K (72,4 °C) sous 1 bar | |
| Solubilité | miscible dans l'eau | |
| Masse volumique | 1,5351 (20 °C) | |
| Pression de vapeur saturante | 141 hPa (20 °C) | |
| Point critique | 32,6 bar, 218,15 °C | |
| Thermochimie | ||
| Cp | ||
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 11,46 eV (gaz) | |
| Propriétés optiques | ||
| Indice de réfraction |
| |
| Précautions | ||
| | ||
| ||
| Phrases R : 20, 35, 52/53, | ||
| Phrases S : (1/2), 9, 26, 27, 28, 45, 61, | ||
| | ||
|
0 3 0 | ||
| | ||
| Produit non classifié | ||
| | ||

Danger | ||
| Composés apparentés | ||
| Anions apparentés | CH3COOH CCl3COOH | |
| | ||
L'acide trifluoroacétique (TFA) est un composé chimique de formule CF3COOH. C'est un acide carboxylique fort en raison de la présence de trois atomes de fluor, fortement électronégatifs. Comparé à l'acide acétique, l'acide trifluoroacétique est environ 100 000 fois plus puissant. Cet acide est très utilisé en chimie organique.
Utilisation
Le TFA est un réactif utilisé fréquemment en synthèse organique en raison de la combinaison de propriétés intéressantes : volatilité, solubilité dans des solvants organiques et force. Il est aussi moins oxydant que l'acide sulfurique mais plus facilement obtenu sous forme anhydre que par exemple l'acide chlorhydrique. Une des complications pour son utilisation est que le TFA forme un azéotrope avec l'eau avec un point d'ébullition à 105 °C (soit 378 K).
Le TFA est aussi utilisé fréquemment comme tampon en chromatographie liquide pour la séparation des composés organiques, et particulièrement des peptides et des petites protéines. C'est un solvant versatile pour la spectroscopie RMN.
L'anhydre dérivé, [CF3C(O)]2O, est un réactif commun pour l'introduction du groupe trifluoroacétyle.

Synthèse
L'électrofluoration de l'acide acétique au moyen de la méthode de Simmons est la meilleure manière d'obtenir l'acide trifluoroacétique. La réaction à l'anode durant l'électrolyse d'un mélange d'un fluorure d'hydrogène et de l'acide acétique au-dessous duquel le fluor élémentaire (F2) se crée est une réaction douce qui laisse le groupe carboxylique intact.
Liens externes
- Fiche sécurité : Baker
Fischer