Atacamite - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| | |||
|---|---|---|---|
| | |||
| | |||
| Formule brute | Cu2Cl(OH)3 | ||
| Numéro CAS | |||
| | |||
| Masse formulaire | 213,57 g/mol | ||
| Couleur | vert, jaune, vert-jaune, vert foncé | ||
| Classe cristalline et groupe d'espace | orthorhombique bipyramidale, Pnma | ||
| Système cristallin | orthorhombique primitif | ||
| Réseau de Bravais | Primitif P | ||
| Macle | très commun sur {544} | ||
| Clivage | parfait sur {110} | ||
| Fracture | Conchoïdale | ||
| Échelle de Mohs | 3 - 3,5 | ||
| Éclat | vitreux-adamantin | ||
| | |||
| Indice de réfraction | α=1,831 β=1,861 γ=1,880 | ||
| Biréfringence | Δ=0,049 ; biaxe négatif | ||
| Dispersion | 2vz ~ 75° | ||
| Fluorescence ultraviolet | aucune | ||
| Trait | vert pomme | ||
| Transparence | Transparant à opaque | ||
| | |||
| Densité | 3,8 | ||
| | |||
| Magnétisme | aucun | ||
| Radioactivité | aucune | ||
| | |||
L'atacamite est une espèce minérale composée d'oxychlorure de cuivre de formule Cu2Cl(OH)3. Les cristaux peuvent atteindre une taille de 10cm.
Inventeur et étymologie
Décrite initialement dans un mémoire de l'Académie Royale des Sciences Examen d'un sable vert cuivreux du Pérou par le Duc de la Rochefoucault, Baumé et de Fourcroy en 1786. C'est la description faite par D. de Gallitzen en 1801 qui fait référence et qui donne son nom à ce minéral ; le nom est inspiré du topotype.
Cristallographie et propriétés physiques
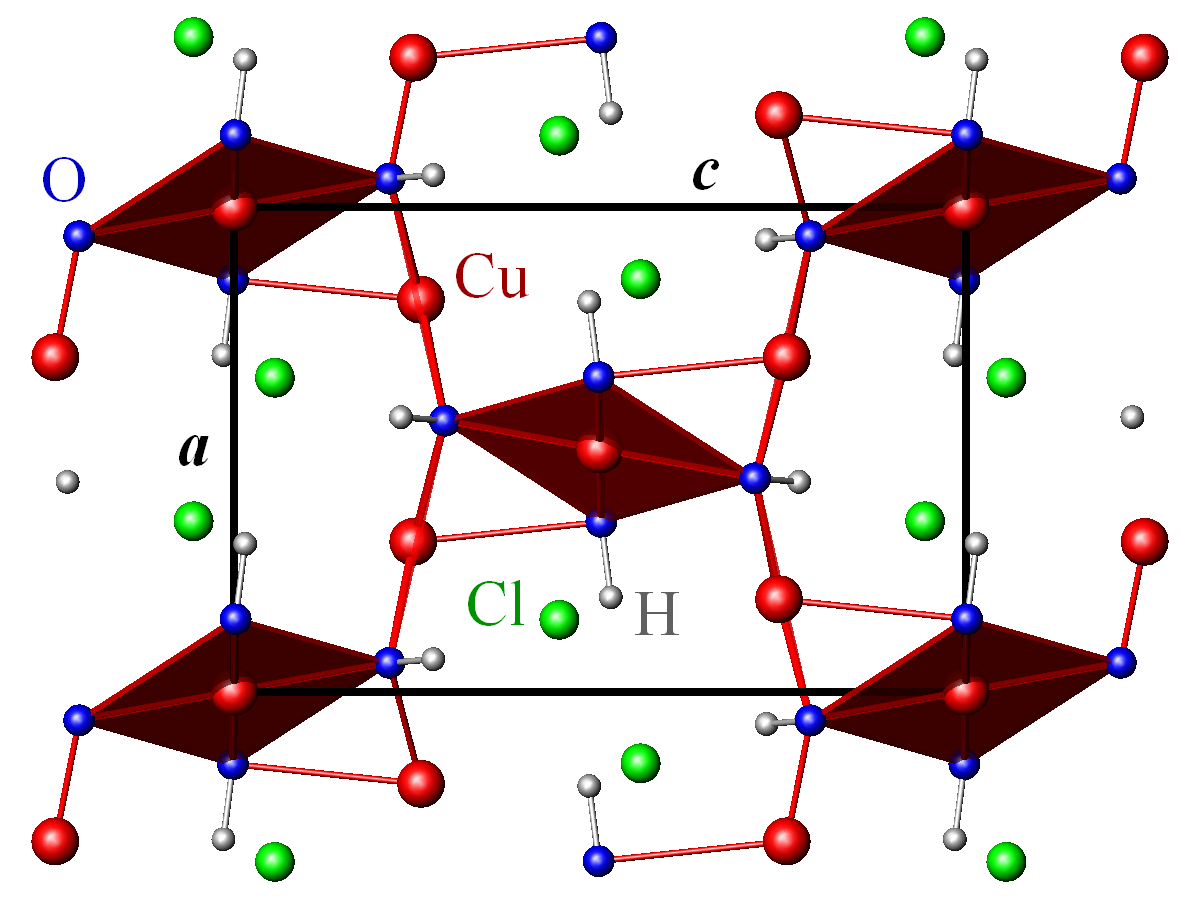
L'atacamite cristallise dans le groupe d'espace orthorhombique Pnma (Z = 4).
- Paramètres de la maille conventionnelle : a = 6,030 Å, b = 6,865 Å, c = 9,120Å ; V = 377,5 Å3
- Densité calculée = 3,76 g/cm3
Les ions Cl– ont une coordination trigonale prismatique (3+3) de cuivre et d'hydrogène.
Les ions Cu2+ sont situés sur deux sites non-équivalents, Cu1 et Cu2. Cu1 (aux sommets et au centre de la maille) est en coordination octaédrique déformée (4+2) de groupes hydroxyles (OH) et de chlore, Cu2 est en coordination octaédrique déformée (5+1) d'OH et Cl. Les groupes octaédriques de cuivre sont reliés entre eux par leurs arêtes de façon similaire aux octaèdres AlO6 dans la structure de la spinelle.
La distribution des longueurs de liaison dans les octaèdres Cu1Cl2(OH)4 et Cu2Cl(OH)5, quatre liaisons Cu-O courtes entre 1,94 Å et 2,02 Å et deux liaisons Cu-O et Cu-Cl plus longues entre 2,34 Å et 2,78 Å, est typique de l'effet Jahn-Teller rencontré dans les composés de Cu(II) et permet une description alternative de la structure en termes de groupes plans carrés Cu(OH)4.
Dans cette description, les groupes Cu1(OH)4 sont reliés par un sommet et forment des chaînes en zig-zag le long de la direction b, avec un angle de liaison Cu-O-Cu de 124,5°. Les groupes Cu2(OH)4 sont reliés par leurs arêtes et forment des chaînes non-planes le long de la direction a, avec un angle de liaison Cu-O-Cu de 97,8°. Les chaînes Cu1(OH)3 et Cu2(OH)2, perpendiculaires, sont reliées par deux sommets d'une arête d'un groupe Cu2(OH)4, formant des triangles isocèles de Cu2+.
La connaissance exacte de la configuration géométrique des porteurs de moment magnétique (ici, les ions Cu2+, de spin 1/2) dans un matériau est essentielle pour comprendre ses propriétés magnétiques. Dans les oxydes de Cu(II), les interactions magnétiques entre spins ont en général lieu par superéchange via les atomes d'oxygène, puisqu'il y a recouvrement des orbitales atomiques du cuivre et de l'oxygène. Les angles de liaison Cu-O-Cu jouent un rôle important dans la nature des interactions magnétiques. Comme les angles de liaison dans l'atacamite sont supérieurs à 90°, les interactions le long des deux types de chaînes sont antifféromagnétiques. Cependant, la configuration de spins triangulaire entre les chaînes peut, selon la force des différentes interactions, entraîner une frustration magnétique, empêchant un ordre à longue distance des spins. Des mesures en température de la susceptibilité magnétique ont montré qu'en dessous de T = 9 K, l'atacamite présente un système antiferromagnétique désordonné : les spins ne sont ordonnés que localement (verre de spin).


















































