Équilibre chimique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un système chimique est à l'équilibre lorsque les variables intensives qui le décrivent (température, pression et activités chimiques des réactifs et des produits) sont homogènes dans tout le système et restent constantes au cours du temps.
Une réaction chimique ne se traduit pas toujours par la disparition complète des réactifs en étant qualifiée alors de réaction totale. De nombreuses réactions sont partielles et aboutissent à un équilibre entre les réactifs de départ et les produits de la réaction. L'ampleur de la réaction est caractérisé par l'état d'avancement :
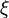
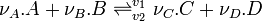
où
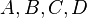
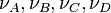
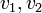
Dans le cas de réactions élémentaires, c'est-à-dire s'effectuant en une seule étape, les vitesses dépendent des concentrations
![[A],[B],[C],[D]~](https://static.techno-science.net/illustration/Definitions/autres/7/7449d544db8f53afc3d3e693a71a6a4e_89ed73223e2145e7494d5a76637b6143.png)
![v_1 = k_1 . [A]^{\nu_A}.[B]^{\nu_B}~](https://static.techno-science.net/illustration/Definitions/autres/f/fb1a5b4d58cd62a8836cba1a8da84f01_e4e6d1efb606c1a5b51ce596281ded92.png)
![v_2 = k_2 . [C]^{\nu_C}.[D]^{\nu_D}~](https://static.techno-science.net/illustration/Definitions/autres/d/d4a7203e25a5c53475c79856a06321f5_000b1b1ad92445ba102c28be48a0b02e.png)
L'égalité des vitesses des réactions opposées entraîne la relation suivante:
![\frac {k_1}{k_2} = \frac {[C]^{\nu_C}.[D]^{\nu_D}}{[A]^{\nu_A}.[B]^{\nu_B}} = K_c~](https://static.techno-science.net/illustration/Definitions/autres/0/091d5dfcdc804b5ba0ff0168958683e5_585b620ddadf58ee52ab7453e38d1a49.png)
Guldberg et Waage (1865), en s'inspirant de propositions de Berthollet, ont ainsi montré empiriquement qu'il existait une relation entre les concentrations des espèces présentes à l'équilibre en solution.
La constante d'équilibre
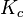
Le développement ultérieur de la thermodynamique et l'application de la fonction enthalpie libre : G aux réactions chimiques effectuées à température et pression constante, a permis de démontrer cette loi d'action des masses et d'établir la relation formulée empiriquement par Guldberg et Waage. Pour cela, il est nécessaire de définir précisément des grandeurs de réaction indispensables à la compréhension des phénomènes : enthalpie libre de réaction,
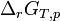
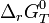
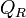
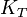
Le développement mathématique qui suit est plutôt difficile, mais il est essentiel pour comprendre les relations, leurs conditions d'application et leurs limites.
Réaction chimique et avancement de réaction
- Considérons une réaction chimique effectuée à température et pression constantes dont l'équation bilan est la suivante:
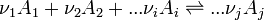
- Les constituants du premier membre (réactifs) sont indicés
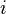
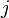
Lorsque la réaction progresse les constituants
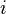
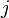
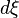
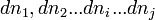
La réaction progresse en respectant la stœchiométrie de l'équation bilan ce qui implique que tous les rapports
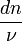
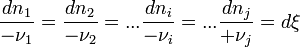
La variable