Hybridation (chimie) - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En chimie, l'hybridation des orbitales atomiques est le mélange des orbitales atomiques d'un atome appartenant à la même couche électronique de manière à former de nouvelles orbitales qui permettent mieux de décrire qualitativement les liaisons entre atomes. Les orbitales hybrides sont très utiles pour expliquer la forme des orbitales moléculaires. L'hybridation des orbitales atomiques fait également partie intégrante de la théorie VSEPR (Valence Shell Electronic Pairs Repulsion).
Exemple du méthane
La théorie des orbitales hybrides a été développée par Linus Pauling pour expliquer la géométrie de molécules comme le méthane (CH4). La difficulté de compréhension de cette dernière a pour cause les raisons suivantes.
Il s'agit d'une molécule constituée d'un atome de carbone lié à quatre atomes d'hydrogène. La configuration électronique du carbone dans son état fondamental est 1s² 2s² 2px¹ 2py¹, ou
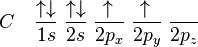
(l'orbitale atomique 1s est plus basse en énergie que l'orbitale 2s, cette dernière étant elle-même plus basse en énergie que les orbitales 2p).
De prime abord, il semblerait que l'atome de carbone ne doive former que deux liaisons covalentes du fait de l'existence de deux orbitales 2p à moitié remplies. Cependant, CH2 ou méthylène n'existe pas en tant que tel mais uniquement comme groupement à l'intérieur de molécules. Ce raisonnement ne permet pas d'expliquer l'existence du méthane.
Par ailleurs un raisonnement impliquant un état excité ne permettrait pas d'expliquer les propriétés du méthane. Si un électron de l'orbitale 2s est excité et occupe l'orbitale 2pz, le carbone peut alors être lié à quatre atomes d'hydrogène (4 orbitales du carbone sont à moitié remplies). Cependant, la forme des orbitales 2s et 2p étant très différentes, le recouvrement avec les orbitales des différents atomes d'hydrogène sera différent, et les quatre liaisons C-H n'auront pas la même énergie ce qui est contraire aux résultats expérimentaux.
Forme des molécules
Alliée à la théorie VSEPR, l'hybridation des orbitales permet d'expliquer qualitativement la géométrie des molécules :
| Orbitales hybrides | Géométrie | type de molécule | |
|---|---|---|---|
| sp | linéaire | AX2 (ex : BeCl2) | |
| sp2 | trigonale | AX3 (ex : BCl3, graphite) | |
| sp3 | tétraédrique | AX4 (ex : CH4) | |
| sp3d | bipyramide trigonale | AX5 (ex : PCl5) | |
| sp3d2 | octaèdrique | AX6 (ex : SF6); AX5E (ex:ClF5) | |
| dsp2 | plan-carré | (ex : complexe du cuivre) |
Ces exemples sont valables lorsque l'atome central ne porte pas en plus une paire d'électrons. Si tel est le cas, celle-ci est décomptée avec Xi mais les angles de liaisons sont différents. C'est le cas par exemple pour la molécule d'eau H2O : la géométrie est bien tétraédrique (en prenant en compte les doublets électroniques), mais le tétraèdre est déformé (angle HOH de 104,5 degrés).
De telles déformations (de quelques degrés seulement) sont anecdotiques et la forme générale des polyèdres réguliers peut être retenue.
Au-delà des systèmes de type AX4, c'est-à-dire au-delà de l'hybridation sp3, on voit apparaître des orbitales d dont la participation à la liaison est très controversée, et pour le moins délicate à expliquer. En fait, on peut très bien construire les orbitales moléculaires d'une bipyramide trigonale sans avoir recours aux orbitales d. Mieux, les méthodes quantiques conduisent à PCl5 en bipyramide trigonale alors même qu'aucune orbitale d ne figure dans le calcul.
Les qualifier de parfaitement inutiles est sans doute un peu exagéré, mais ces hybridations sp3d ou sp3d2 et dsp2 ne peuvent avoir en tous cas qu'un rôle très marginal dans notre compréhension de la chimie : ces systèmes sont bien mieux décris par la théorie des Orbitales Moléculaires délocalisées.

















































