Leishmaniose - Définition
La liste des auteurs de cet article est disponible ici.
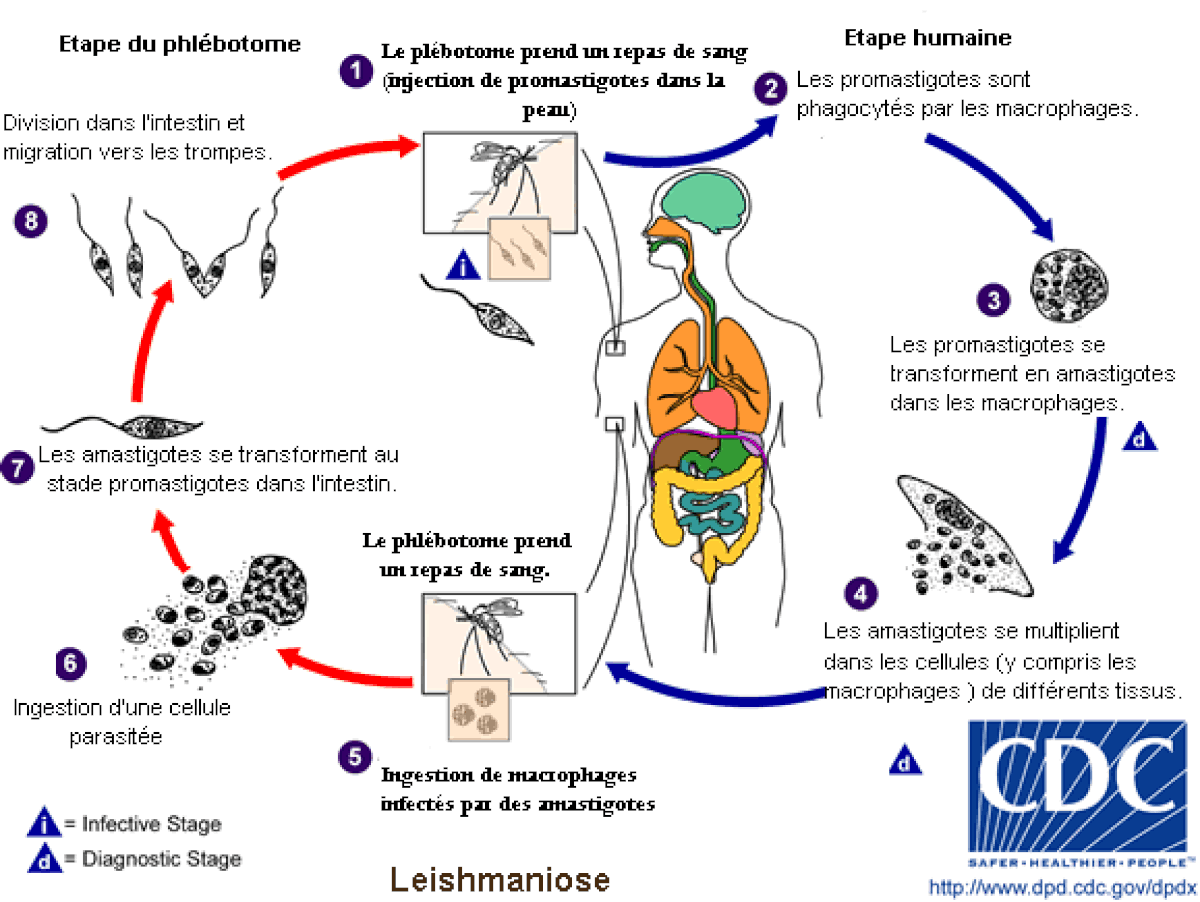
Cycle parasitaire
La leishmaniose est transmise par la piqûre des phlébotomes femelles. Les phlébotomes injectent la larve au stade infectieux, de promastigotes métacycliques, pendant le repas de sang (1). Les promastigotes métacycliques qui atteignent la plaie de piqûre sont phagocytées par les macrophages (2) et se transforment en amastigotes (3). Les amastigotes se multiplient dans les cellules infectées et atteignent différents tissus, suivant (du moins en partie) l’espèce de Leishmania qui est impliquée (4). Ces spécificités d’atteinte tissulaires différentes sont la cause des manifestations cliniques qui différent dans les diverses formes de leishmaniose. Les phlébotomes s’infectent pendant les repas de sang sur un hôte infecté quand ils ingèrent des macrophages porteurs d’ amastigotes (5.6). Dans l’intestin du phlébotome, les parasites se différencient en promastigotes (7), qui se multiplient et se différencient en promastigotes metacycliques et migrent dans la trompe du phlébotome (8).
Cycle évolutif: http://leish.ifrance.com/Utilitaires/Cycle.swf
La leishmaniose chez le chien
La leishmaniose est, nous l'avons dit, une maladie commune au chien et à l'homme. Les zones endémiques sont donc les mêmes. La transmission du chien à l'homme est possible par l'intermédiaire du phlébotome. C'est dire qu'il est important d'en connaître les signes chez l'animal.
La maladie peut être grave chez l'animal mais certaines espèces vivant en zone d'endémicité ont développé une résistance à la maladie et sont des porteurs sains (ils hébergent le parasite sans être malades pour autant). Ils constituent alors un réservoir de leishmania.
Les symptômes de la maladie dépendent des organes atteints. C'est dire leur extrême polymorphisme qui rend le diagnostic d'autant plus difficile.
Les principaux signes qui doivent attirer l'attention chez un chien dont ont sait qu'il a séjourné dans des zones d'endémicité sont:
- Un amaigrissement progressif
- des lésions cutanées ulcérantes principalement au niveau de la truffe (narines), des oreilles et des coussinets ou une simple dermatite sèche (pellicules) avec chute des poils,
- Des griffes anormalement longues,
- Des épistaxis répétées et parfois impressionnantes. Ce sont elles qui amènent généralement le propriétaire à consulter.
Le vétérinaire constatera une augmentation du volume des ganglions, de la rate (splénomégalie) et/ou du foie (hépatomégalie).
D'autres signes sont inconstants :
- Fièvre,
- Atteinte oculaire avec des yeux rouges, larmoyants et douloureux (kératite, conjonctivite, Kérato-conjonctivite,uvéite)
- Atteinte rénale particulièrement grave qui se manifeste par une propension de l'animal à boire beaucoup (polydipsie) et, par voie de conséquence, à uriner exagérément (polyurie).
Le diagnostic est confirmé par la découverte du protozoaire dans un prélèvement fait dans le fond des lésions cutanées ou par la sérologie.
Le pronostic est toujours réservé car le traitement est long, parfois mal supporté par le chien et pas toujours efficace.
Traitement
Il existe deux molécules couramment utilisées contenant de l’antimoine, l’antimoniate de meglumine ( Glucantim ®) et le stibogluconate de sodium ( Pentostam ®). On n’a pas complètement élucidé le mécanisme d’action de ces produits contre le parasite ; elles peuvent perturber son mécanisme de production d’énergie ou le métabolisme de la trypanothione. Malheureusement, dans beaucoup de régions du monde, le parasite est devenu résistant à l'antimoine et pour la leishmaniose viscérale ou cutanéo-muqueuse l'amphotéricine ( Ambisome ®) est maintenant le traitement de choix. L'échec de l'Ambisome® pour traiter la leishmaniose viscérale (Leishmania donovani) a été rapporté au Soudan. Mais cet échec peut être attribué à des facteurs dépendants de l’hôte, telles la co-infection avec le VIH ou la tuberculose davantage que par la résistance du parasite.
La Miltefosine (Impavido®), est un nouveau médicament pour traiter la leishmaniose viscérale et cutanée. Le taux de bons résultats pour la miltefosine dans la phase III des essais cliniques est de 95% ; Des études en Éthiopie montrent qu’il est également efficace en Afrique. Chez les malades immunodéprimés atteints du VIH et qui sont co-infectées par la leishmaniose, il a été prouvé que même dans les formes résistantes 2/3 des patients réagissent à ce nouveau traitement. Des essais cliniques en Colombie ont montré un taux d’efficacité élevé pour la leishmaniose cutanée. Dans les formes cutanéo-muqueuses provoquées par L. brasiliensis ce traitement s’est montré plus efficace que d'autres molécules. La Miltefosine a reçu l'autorisation de mise sur le marché des autorités indiennes en 2002 et allemandes en 2004. En 2005 il a reçu la première autorisation pour la leishmaniose cutanée en Colombie. La Miltefosine est actuellement évaluée également pour le traitement de la leishmaniose cutanéo-muqueuse provoquée par le L. braziliensis en Colombie et les résultats préliminaires sont très prometteurs. Il est maintenant autorisé dans de nombreux pays et c’est la première percée thérapeutique pour un traitement administré par voie orale pour la leishmaniose viscérale et cutanée(More, et al, 2003).
En octobre 2006 il a reçu le statut médicament orphelin de la Food and drug administration des USA. La molécule est généralement mieux tolérée que d'autres médicaments. Les effets secondaires principaux sont des troubles de gastro-intetinaux dans les 1 à 2 premiers jours du traitement ce qui n'affecte pas son efficacité. Puisqu'il est disponible pour un traitement par voie orale, il évite les dépenses et les inconvénients de l'hospitalisation, ce qui fait de lui une alternative intéressante.
L'institut pour la santé mondiale a développé la paromomycine, dont les résultats ont conduit à son inscription comme médicament orphelin.
L'initiative des médicaments pour les maladies négligées facilite également activement la recherche pour de nouvelles thérapeutiques. La leishmaniose résistante aux médicaments peut répondre favorablement à l'immunothérapie (inoculation d’antigènes du parasite associés à un adjuvant) qui vise à stimuler le propre système immunitaire du malade pour éliminer le parasite.
Plusieurs vaccins potentiels sont développés, à la demande de l'organisation mondiale de la santé, mais aucun n'est encore disponible en date de 2010. L'équipe du laboratoire de chimie organique à l'institut fédéral de technologie suisse (ETH) à Zurich essaye de concevoir un vaccin à base d'hydrates de carbone. [5]. Le génome du parasite Leishmania major a été séquencé ce qui rend probablement possible l'identification des protéines qui sont utilisées par l’agent pathogène mais pas par les humains ; ces protéines sont les cibles potentielles pour des traitements médicamenteux.