Mole (unité) - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La mole (symbole : mol) est une unité de base du système international, apparue en 1971, qui est principalement utilisée en physique et en chimie. La mole est la quantité de matière d'un système contenant autant d'entités élémentaires qu'il y a d'atomes dans 12 grammes de carbone 12 ; son symbole est mol.
Une mole d’atomes contient environ 6,02214179(30)×1023 atomes. Ce nombre est appelé constante d'Avogadro, son symbole est N.
Formulé de manière plus compréhensible, la mole est une unité de comptage au même titre que la centaine, la vingtaine ou la douzaine, sauf que cette unité de comptage est immense (environ 600 000 milliards de milliards d'unités). De la même manière qu'il y a autant d'éléments dans une douzaine de pommes que dans une douzaine d'œufs, il y a le même nombre d'atomes dans une mole de carbone que dans une mole de plomb (ie. 602 214 milliards de milliards d'atomes).
Un échantillon de matière de taille macroscopique contient un très grand nombre d'atomes. Par exemple, 6 grammes d'aluminium contiennent environ 1,34×1023 atomes (134 000 000 000 000 000 000 000 atomes ; soit 134 mille milliards de milliards). Pour éviter l'utilisation d'aussi grands nombres, on a créé une unité de mesure, la mole (dans le cas présent 6 g d'aluminium représentent 0,22 mole d'atomes). La masse d'une mole de matière ou masse molaire, lorsqu'elle est exprimée en grammes, correspond en première approximation au nombre de nucléons de l'élément (27 nucléons pour l'aluminium).
Étymologie
Au départ, la langue anglaise utilisait le terme de molécule-gramme ou d'atome-gramme pour désigner la masse moléculaire (masse molaire). Le terme provenait du latin « molecula », signifiant « masse ». Un diminutif est finalement apparu pour désigner la quantité de matière : la mole.
Formules
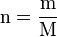
- n : quantité de matière en mol .
- m : masse du composé en g
- M : masse molaire du composé en
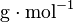
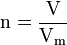
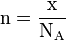
- n : quantité de matière en mol
- x : nombre d'entités chimiques (sans dimension).
- N : nombre d'Avogadro (mol − 1)
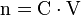
- n : quantité de matière en mol
- C : concentration molaire en
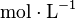
- V : volume du liquide en L (Litres)
Multiples
Comme toutes les unités, les multiples de la mole sont décrits avec les préfixes du système international d'unités. Son sous-multiple le plus courant est la millimole (mmol) = 10-3 mol. Il est essentiel d'indiquer la nature des entités élémentaires : une mole d’atomes, de molécules, d'ions, d'électrons, d'autres particules, de groupes de particules…
| 10N | Préfixe | Symbole | Nombre |
|---|---|---|---|
| 1024 | yottamole | Ymol | Quadrillion |
| 1021 | zettamole | Zmol | Trilliard |
| 1018 | examole | Emol | Trillion |
| 1015 | pétamole | Pmol | Billiard |
| 1012 | téramole | Tmol | Billion |
| 109 | gigamole | Gmol | Milliard |
| 106 | mégamole | Mmol | Million |
| 103 | kilomole | kmol | Mille |
| 102 | hectomole | hmol | Cent |
| 101 | décamole | damol | Dix |
| 100 | mole | mol | Un |
| 10-1 | décimole | dmol | Dixième |
| 10-2 | centimole | cmol | Centième |
| 10-3 | millimole | mmol | Millième |
| 10-6 | micromole | μmol | Millionième |
| 10-9 | nanomole | nmol | Milliardième |
| 10-12 | picomole | pmol | Billionième |
| 10-15 | femtomole | fmol | Billiardième |
| 10-18 | attomole | amol | Trillionième |
| 10-21 | zeptomole | zmol | Trilliardième |
| 10-24 | yoctomole | ymol | Quadrillionième |
| 10 N | Préfixe | Symbole | Nombre en français | Nombre en chiffre |
|---|---|---|---|---|
| 104 | myriamole | | Dix mille | 10 000 |
| 10-4 | myriomole | | Dix-millième | 0,000 1 |
Ordre de grandeur
Pour donner un ordre de grandeur, une mole de secondes représenterait un peu plus de 4 millions de fois l'estimation de l'âge de la Terre : ~19×1015 ans.
Une mole de grains de maïs éclaté permettrait de recouvrir la surface des États-Unis d'une couche uniforme d'une épaisseur d'environ 14 km.
Toujours pour un ordre de grandeur, une mole de grains de sable de 0,1 mm (sable très fin) est contenue dans un volume de 10 km3, soit celui d'un cube de 2,15 km de côté. (cf: livre de référence.)