Phtalimide - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Phtalimide | |
|---|---|
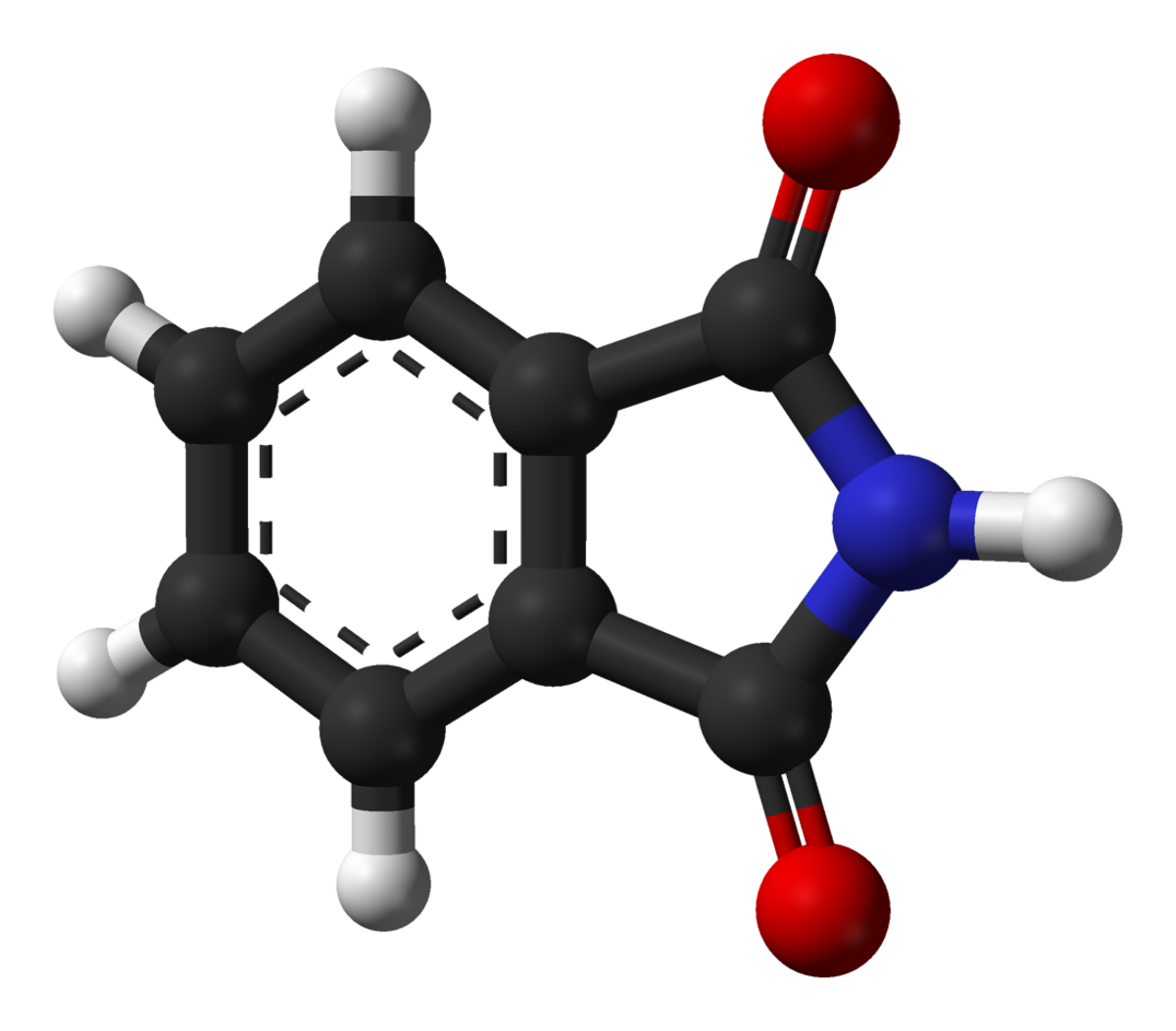
| |
| Général | |
| Nom IUPAC | |
| No CAS | |
| No EINECS | |
| SMILES | |
| InChI | |
| Apparence | solide blanc |
| Propriétés chimiques | |
| Formule brute | C8H5NO2 |
| Masse molaire | 147,1308 ± 0,0076 g·mol-1 |
| pKa | 8,3 |
| Propriétés physiques | |
| T° fusion | 238 °C |
| T° ébullition | 336 °C (sublimation) |
| Solubilité | 360 mg·l-1 (eau, 25 °C) 0,6 g·l-1 (eau) |
| Masse volumique | 1,21 g·cm-3 à 20 °C |
| Point d’éclair | 165 °C DIN 51758 |
| Écotoxicologie | |
| LogP | 1,15 |
| Composés apparentés | |
| Autres composés | maleimide (amides) et anhydride phtalique |
| | |
Le phtalimide est un imide aromatique, c'est-à-dire un composé organique avec deux groupements carbonyle liés à un atome d'azote trigonal. C'est l'imide de l'acide benzène-1,2-dicarboxylique (acide phtalique).
Propriétés
Le phtalimide est un solide blanc cristallisé à température ambiante. Il est pratiquement insoluble dans l'eau froide, très peu soluble dans le benzène et l'éther de pétrole, et assez soluble dans l'éthanol chaud, l'acide éthanoïque et les bases concentrées.
Réactivité
Réaction de Gabriel
La principale réaction utilisant le phtalimide est la synthèse de Gabriel des amines primaires. Cette réaction porte le nom du chimiste allemand Siegmund Gabriel, qui l'a mise au point.
La première étape de la réaction est la déprotonation de l'imide. L'atome d'hydrogène de la fonction imide présente un caractère assez acide. L'anion imidure, base conjuguée de l'acide imide, est stabilisé par effet mésomère, dû à la présence des deux groupes carbonyle électrophiles liés à l'atome d'azote. Le phtalimide peut donc être facilement déprotonné. Il forme des sels avec différents cations métalliques, tels que les ions potassium et sodium. Ces sels peuvent être obtenus par réaction avec les carbonates métalliques correspondants. Le pthalimidure de potassium peut être synthétisé en faisant réagir le phtalimide avec le carbonate de potassium dans l'eau à 100 °C, ou par réaction du phtalimide avec une solution alcoolique d'hydroxyde de potassium.
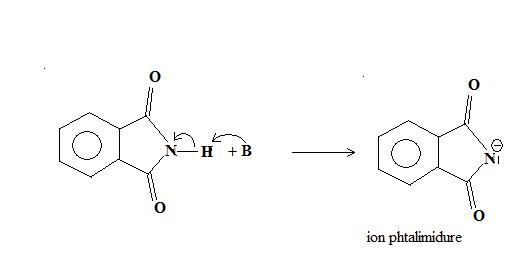
Le produit obtenu est peu basique (moins que les amidures), mais est un bon nucléophile. Il réagit avec les composés organiques halogénés, dans une réaction de substitution nucléophile bimoléculaire, de type SN2. La réaction est assez lente, mais est accélérée par chauffage et l'utilisation d'un solvant polaire aprotique, tel que le diméthylformamide (DMF).
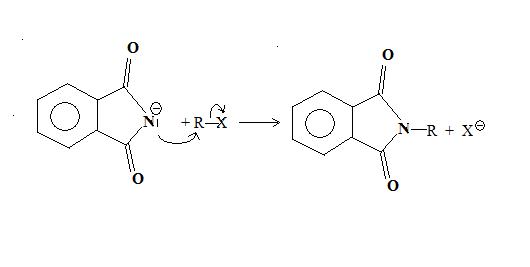
L'atome d'azote du N-alkylphtalimide obtenu est très peu nucléophile, à cause de la présence des deux groupements carbonyle. Il n'a donc pas tendance à donner de substitution nucléophile avec une seconde molécule d'halogénure. Du coup, on évite la polyalkylation, qui est le principal inconvénient de la réaction d'Hofmann.
L'hydrolyse de l'intermédiaire réactionnel, en milieu basique concentré, conduit à la formation d'une amine, l'ion benzène-1,2-dioate (phtalate) étant obtenu comme sous-produit.
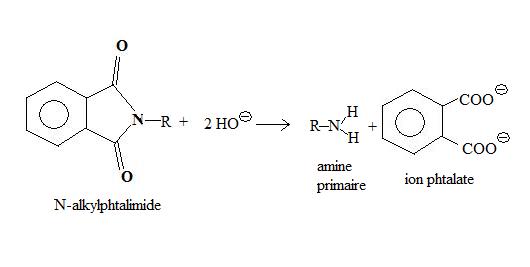
Le chauffage,nécessaire lors de la dernière étape, conduit à une dégradation importante des produits. Ing et Manske ont mis au point une variante, dans laquelle la base utilisée pour la dernière étape est l'hydrazine, qui agit à température ambiante, et évite les pertes de l'hydrolyse à chaud.
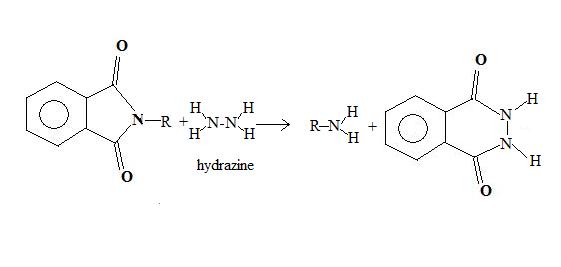
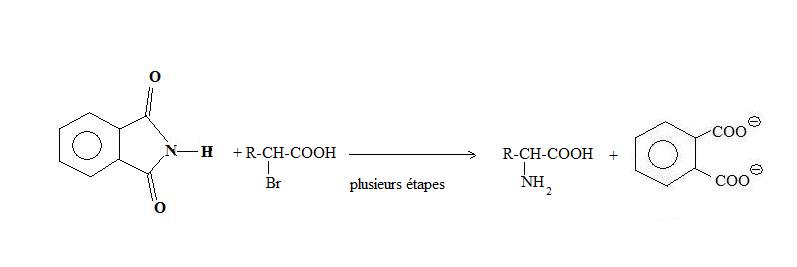
Synthèse des α-amino-acides
Les acides α-aminés puvent être synthétisés par la réaction de Gabriel du phtalimide avec l'acide α-bromé correspondant.
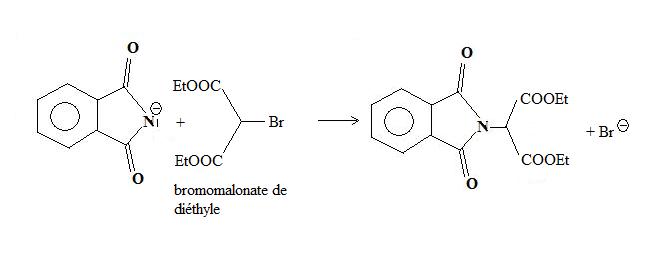
L'utilisation, comme réactif halogéné, du 2-bromopropane-1,3-dioate d'éthyle (bromomalonate d'éthyle) permet une synthèse de nombreux acides α-aminés.
L'imidure est d'abord alkylé par l'ester bromomalonique.
L'alkylimide porte un hydrogène acide, en α de l'azote, qui est facilement arraché par une base, généralement l'ion éthanolate.
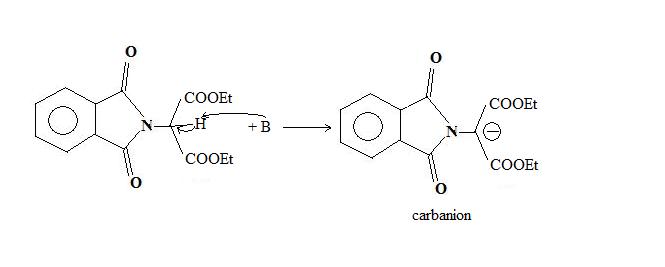
Le carbanion ainsi formé est alors utilisé comme nucléophile, lors d'une réaction de substitution nucléophile sur un composé organique halogéné. C'est à cette étape que l'on introduit le reste R de l'acide α-aminé.
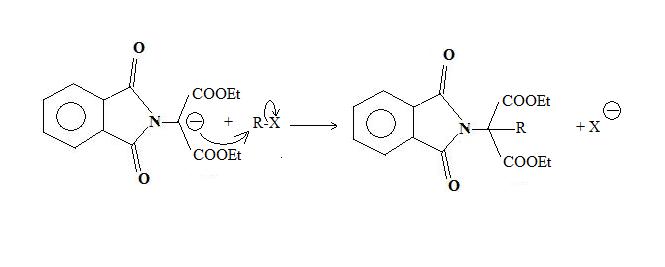
L'hydrolyse basique conduit enfin à la base conjuguée de l'acide α-aminé.
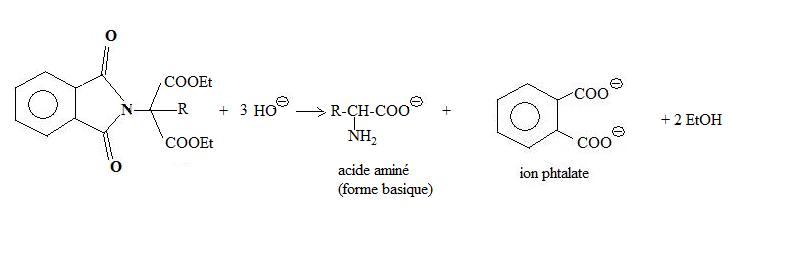
Avec ce réactif, la synthèse de Gabriel de l'acide aminométhanoïque (glycine) a un rendement de 85 %.
Réarrangement d'Hoffmann
L'action de l'ion hypochlorite en solution aqueuse conduit, par réarrangement d'Hoffman, à la formation de l'acide anthranilique, précurseur dans la synthèse de l'indigo.

















































