Sulfate de thallium - Définition
Source: Wikipédia sous licence CC-BY-SA 3.0.
La liste des auteurs de cet article est disponible ici.
La liste des auteurs de cet article est disponible ici.
| Sulfate de thallium | |||
|---|---|---|---|
| |||
| Général | |||
| Synonymes | Sulfate de thallium (I) | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | cristaux inodores, blancs ou incolores. | ||
| Propriétés chimiques | |||
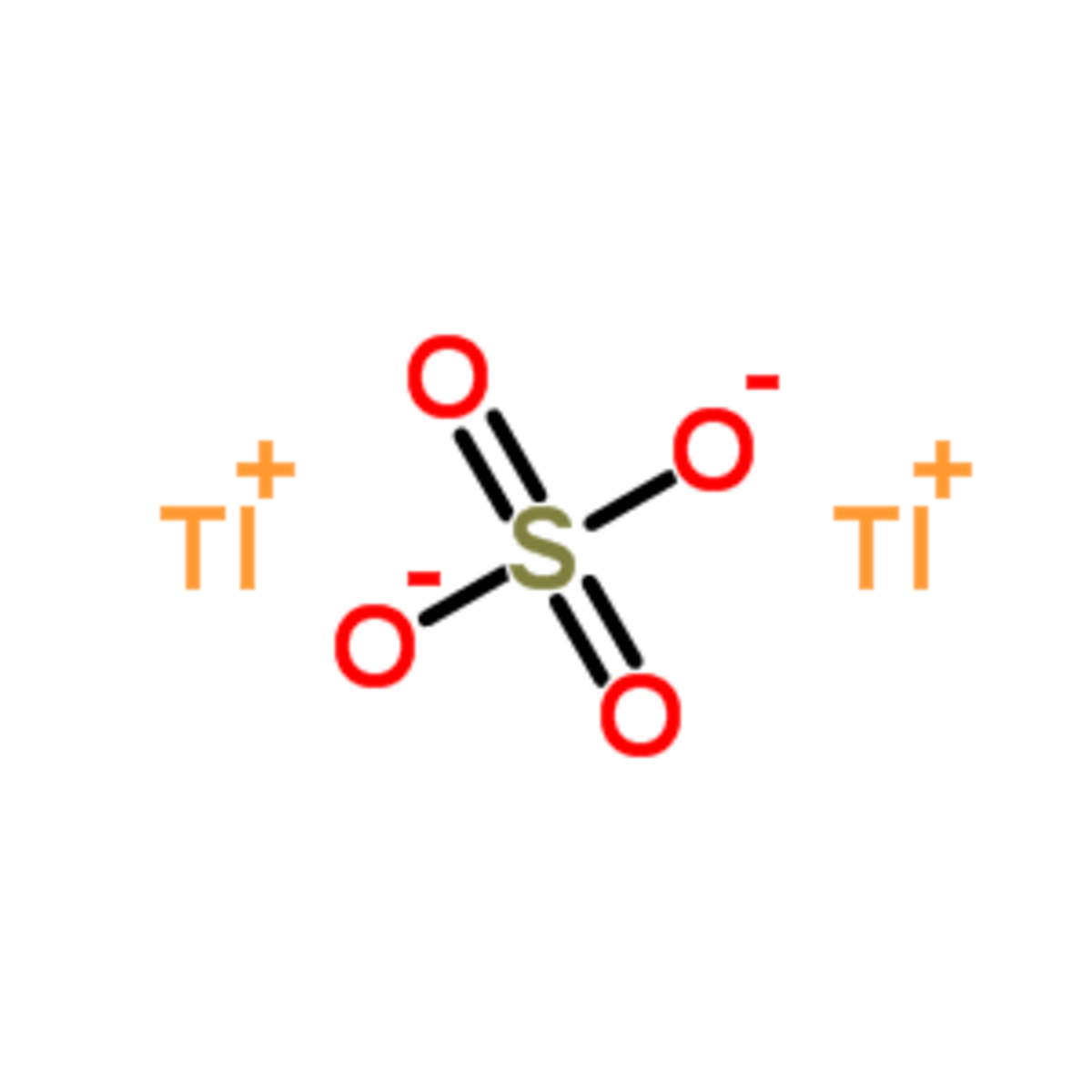
| Formule brute | Tl2SO4 | ||
| Masse molaire | 504,829 ± 0,007 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 632 °C | ||
| Solubilité | dans l'eau à 20 °C : 48,7 g·l-1 | ||
| Masse volumique | 6,77 g·cm-3 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 28, 38, 48/25, 51/53, | |||
| Phrases S : 1/2, 13, 36/37, 45, 61, | |||
| | |||
| |||
| | |||

| |||
| | |||


Danger | |||
| Écotoxicologie | |||
| DL | 25 mg·kg-1 rats Ingestion | ||
| | |||
Le sulfate de thallium, de formule Tl2SO4, est un solide cristallin blanc, inodore et sans goût. On l'utilise comme fourmicide et raticide. Le thallium se substitue au potassium dans le corps, inhibant la pompe sodium/potassium. Il provoque un gonflement du disque optique et une détérioration de la vue.
Traitement :
- charbon actif,
- Bleu de Prusse, ferrocyanure ferrique, K4[Fe(CN)6]3.
Les empoisonnements par thallium peuvent être détectés par analyse spectrale, même après la crémation du corps.
De faibles traces d'isotopes radioactifs sont utilisées dans les analyses médicales.