Trinitrotoluène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Trinitrotoluène | |||||
|---|---|---|---|---|---|
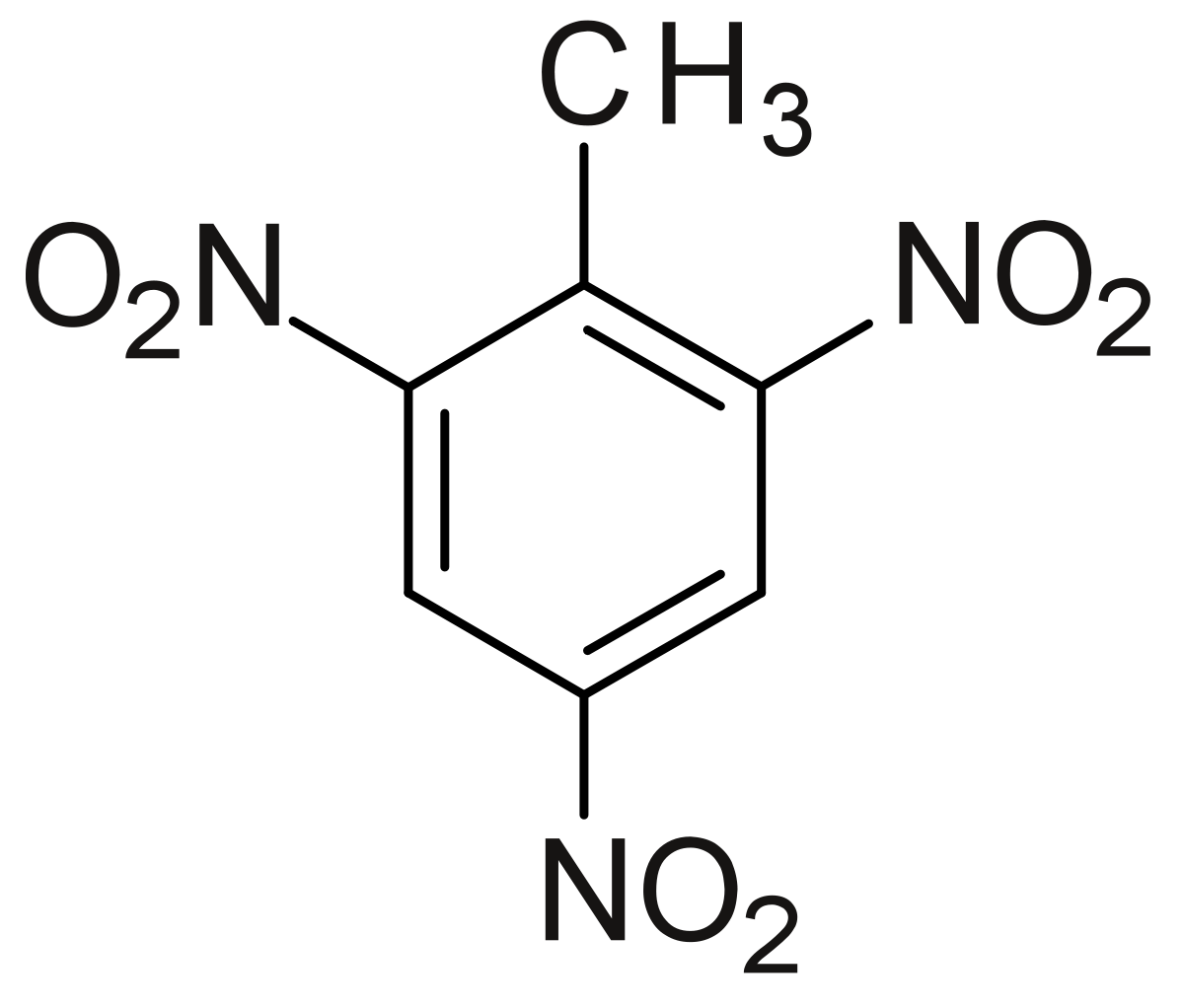
| |||||
| Général | |||||
| Nom IUPAC | |||||
| No CAS | |||||
| No EINECS | |||||
| Apparence | cristaux incolores à jaunes. | ||||
| Propriétés chimiques | |||||
| Formule brute | C7H5N3O6 | ||||
| Masse molaire | 227,1311 ± 0,0084 g·mol-1 | ||||
| Propriétés physiques | |||||
| T° fusion | 80,1 °C | ||||
| T° ébullition | (décomposition) : 240 °C | ||||
| Solubilité | dans l'eau à 20 °C : 0,19 g·l-1, bonne dans l'éther, l'acétone, le benzène | ||||
| Masse volumique | 1,65 g·cm-3 | ||||
| Pression de vapeur saturante | 0,057 hPa (81 °C) | ||||
| Thermochimie | |||||
| Cp | |||||
| Précautions | |||||
| | |||||
| |||||
| Phrases R : 2, 23/24/25, 33, 51/53, | |||||
| Phrases S : 1/2, 35, 45, 61, | |||||
| | |||||
| |||||
| | |||||


| |||||
| | |||||



Danger | |||||
| | |||||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme | |||||
| Écotoxicologie | |||||
| LogP | 1,60 | ||||
| | |||||
Le trinitrotoluène (TNT) est un explosif, utilisé dans plusieurs mélanges, notamment en proportion égale avec le nitrate d'ammonium pour former l’amatol.
Historique
Le TNT a été découvert en 1863 par le chimiste allemand Joseph Wilbrand. Son potentiel explosif n'a pu être observé que plusieurs années plus tard, en raison de la difficulté à mettre au point un détonateur efficace vu son peu de sensibilité et parce qu'il était moins puissant que d'autres explosifs.
Cependant, il a plusieurs propriétés qui lui permettent d'être intégré au sein des torpilles et ainsi d'avoir un pouvoir destructeur plus important que les autres explosifs alors utilisés, comme l'acide picrique. L'armée allemande l'adopta en 1902, tandis que les Britanniques l'ont progressivement intégré à leur arsenal à partir de 1907.
C'est ainsi que, durant la Première Guerre mondiale, le pouvoir destructeur des torpilles de la marine impériale allemande était plus important que celui des britanniques car elles explosaient après avoir perforé la coque, tandis que les torpilles britanniques explosaient à son contact et donc dissipaient à l'extérieur du bateau une partie de l'énergie dégagée par l'explosion.
Explosif
Lors de l'explosion le TNT se décompose comme suit :
2 C7H5N3O6 → 3 N2 + 5 H2O + 7 CO + 7 C
et surtout:
2 C7H5N3O6 → 3 N2 + 5 H2 + 12 CO + 2 C
Sous sa forme raffinée, le trinitrotoluène est relativement stable et moins sensible que la nitroglycérine aux chocs et au transport. Son action explosive doit être amorcée par un détonateur. Il n'intéragit pas avec les métaux et n'absorbe pas l'eau, ce qui lui assure une stabilité pour des stockages assez longs, contrairement à la dynamite, mais il peut former des composés instables au contact de métaux alcalins.
L'énergie spécifique de combustion du TNT est de 4,6 mégajoule/kg, soit 1 kilotonne TNT = 4,6 TJ (térajoule), 1 mégatonne de TNT = 4,6 PJ (pétajoule). Par convention, pour mesurer l’énergie dégagée lors d’une explosion, on utilise le facteur de conversion 1 kg de TNT = 1×106 cal = 4,6 MJ.
On peut remarquer que les explosifs (non-nucléaires) produisent moins d’énergie par kilogramme que des produits alimentaires comme les matières grasses (38 mégajoule/kg) ou le sucre (17 mégajoule/kg). On peut noter trois différences essentielles entre ces chiffres :
- Les énergies spécifiques de combustion des combustibles ordinaires sont calculées sans tenir compte de la masse d'oxygène nécessaire à la combustion : si l'on en tient compte, il faut diviser le chiffre par plus de quatre pour les matières grasses, et environ deux pour les sucres ;
- La combustion des explosifs nitrés se faisant sans apport d'oxygène atmosphérique, elle est loin d'être complète : la quantité d'oxygène disponible n'est pour le TNT qu'un tiers environ de ce qui serait nécessaire pour une combustion complète ;
- Cependant, les explosifs ont des effets bien plus destructeurs, car ils libèrent leur énergie presque instantanément, n'ayant pas besoin d’oxygène externe pour leur combustion.




















































