Nitroglycérine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Nitroglycerine | |||||
|---|---|---|---|---|---|
| |||||
| Général | |||||
| Nom IUPAC | |||||
| Synonymes | Trinitrate de glycérol Nitroglycérol | ||||
| No CAS | |||||
| No EINECS | |||||
| Code ATC | C01 | ||||
| SMILES | |||||
| InChI | |||||
| Apparence | Liquide légèrement huileux à température ambiante. Incolore à l'état pur et jaune en milieu acide | ||||
| Propriétés chimiques | |||||
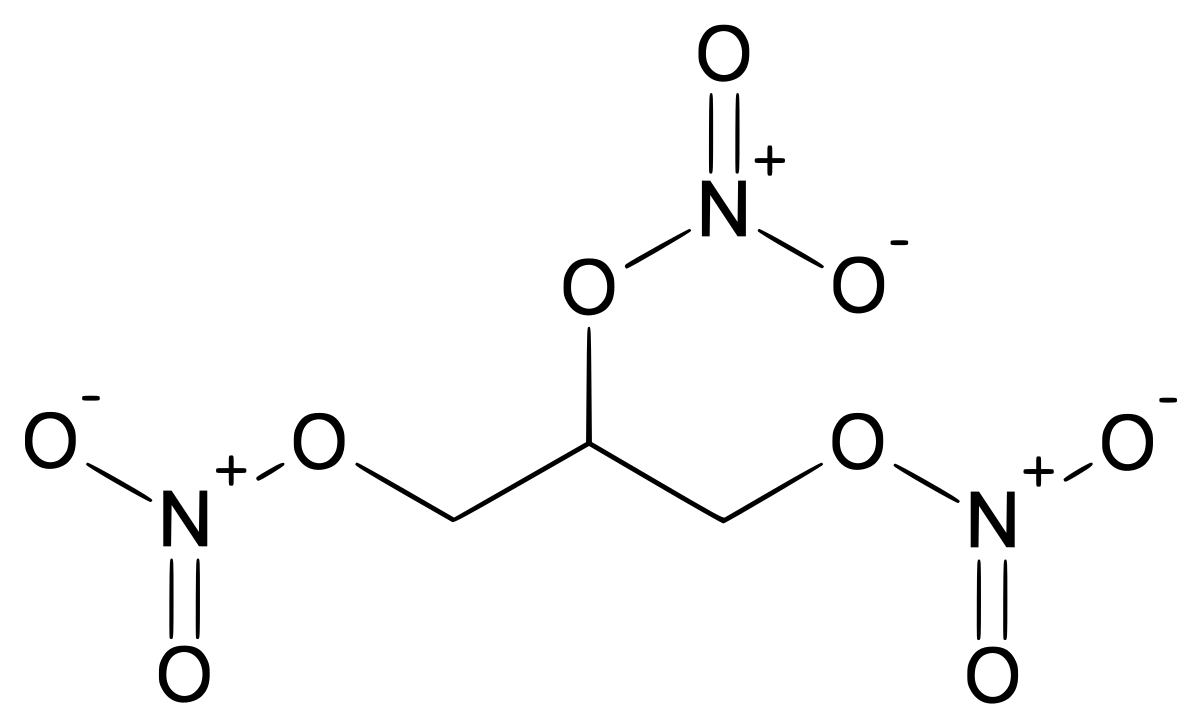
| Formule brute | C3H5N3O9 CH2(ONO2)-CH(ONO2)-CH2(ONO2) | ||||
| Masse molaire | 227,0865 ± 0,0061 g·mol-1 | ||||
| Propriétés physiques | |||||
| T° fusion | 13,5 °C (rhombique) 2,8 °C (triclinique) | ||||
| T° ébullition | 160 °C (20 hPa) Décomposition >50 °C | ||||
| Solubilité | dans l'eau : faible | ||||
| Masse volumique | 1,5931 à 20 °C | ||||
| T° d’auto-inflammation | 270 °C | ||||
| Vitesse de détonation | (cylindre de 30 mm) environ 7 500 m·s-1 | ||||
| Pression de vapeur saturante | à 20 °C : 0,03 Pa | ||||
| Précautions | |||||
| | |||||
| |||||
| Phrases R : 3, 26/27/28, 33, 51/53, | |||||
| Phrases S : (1/2), 33, 35, 36/37, 45, 61, | |||||
| | |||||
| |||||
| | |||||
|
3 2 4 | |||||
| | |||||



Danger 


Danger | |||||
| | |||||
La nitroglycérine, ester trinitrique du glycérol, trinitroglycérine, trinitrate de glycérol ou trinitrine est un composé chimique liquide dense, incolore, huileux, explosif et hautement toxique, obtenu par nitration du glycérol. Il est utilisé dans la fabrication d'explosifs, et plus particulièrement de la dynamite, dont on se sert dans les industries de la construction et de la démolition. Il peut également avoir un usage médical, comme vasodilatateur. Lors de sa décomposition, la nitroglycérine prend une teinte jaune en raison de l'acidification du milieu.
Histoire
La nitroglycérine a été découverte par Ascanio Sobrero en 1847, lorsqu'il travaillait avec Théophile-Jules Pelouze à l'université de Turin. Le processus de fabrication industrielle a été élaboré par Alfred Nobel dans les années 1860. Sa société a exporté un mélange de nitroglycérine et de poudre à canon appelé « huile suédoise détonante », qui a été rapidement interdit à la suite d'accidents catastrophiques. Il découvrit également en 1866 qu'on pouvait stabiliser la nitroglycérine en la mélangeant à un sable siliceux d'origine naturelle : le kieselguhr. Par la suite, cela a abouti au développement de la dynamite et des mélanges similaires (dualine et lithofracteur), où l'on ajoute à la nitroglycérine des composés inertes ou des combustibles absorbants (par exemple la nitrocellulose pour fabriquer un gel de couleur jaune, la gélatine explosive).





















































