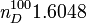Acénaphtène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acénaphtène | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | 1,8-éthylènenaphthalène peri-éthylènenaphthalène naphthylènéthylène | ||
| No CAS | |||
| No EINECS | |||
| No RTECS | AB1000000 | ||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | Poudre cristalline blanche à jaune | ||
| Propriétés chimiques | |||
| Formule brute | C12H10 | ||
| Masse molaire | 154,2078 ± 0,0103 g·mol-1 | ||
| Susceptibilité magnétique | χM 109,3×10-6 cm3·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 95 °C | ||
| T° ébullition | 279 °C | ||
| Solubilité | 3,9 mg·l-1 (eau,25 °C) 36,52 mg·g-1 (éthanol,25,05 °C) 31,10 mg·g-1 (propan-2-ol,24,92 °C) 50,40 mg·g-1 (butan-1-ol,25,1 °C) 401,70 mg·g-1 (toluène,25,08 °C) | ||
| Masse volumique | 1,15 g·cm-3 à 20 °C | ||
| T° d’auto-inflammation | 450 °C | ||
| Point d’éclair | 135 °C | ||
| Thermochimie | |||
| S0 | 188,87 J·K-1·mol-1 | ||
| ΔH0 | 156,8 kJ·mol-1 | ||
| ΔH0 | 72 kJ·mol-1 | ||
| ΔH° | 21,4622 kJ·mol-1 à 93,41 °C | ||
| ΔH° | 63,9 kJ·mol-1 à 25 °C | ||
| Cp | 185,27 J·K-1·mol-1 (solide,17,15 °C) 220,85 J·K-1·mol-1 (gaz,126,85 °C) | ||
| PCI | -6 222 kJ·mol-1 | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 51/53, | |||
| Phrases S : 61, | |||
| | |||
| |||
| | |||
|
1 2 1 | |||
| Écotoxicologie | |||
| CL | 600 mg·kg-1 (rat, i.p.) | ||
| LogP | 3,92 | ||
| Composés apparentés | |||
| Autres composés | Acénaphtène | ||
| | |||
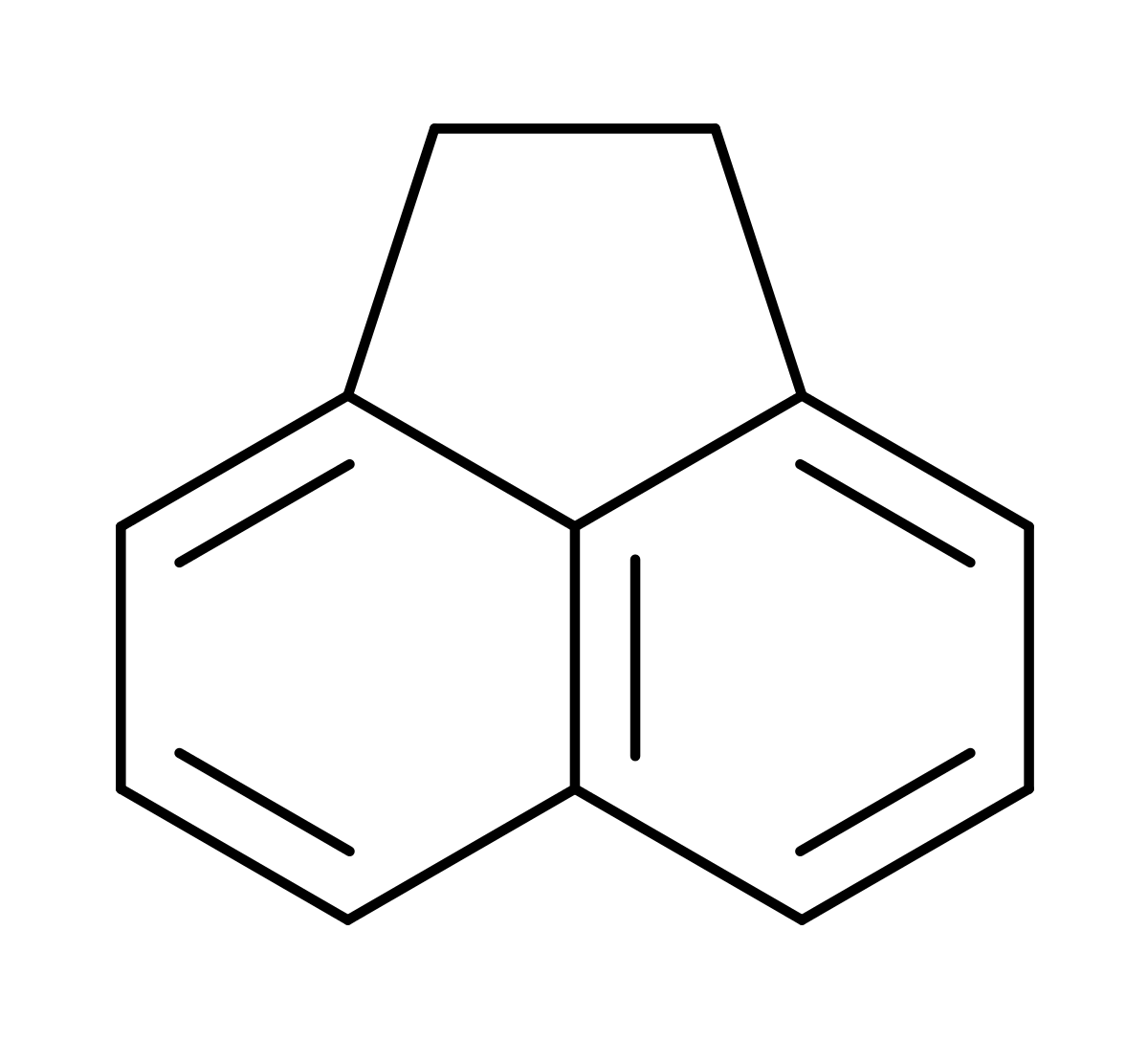
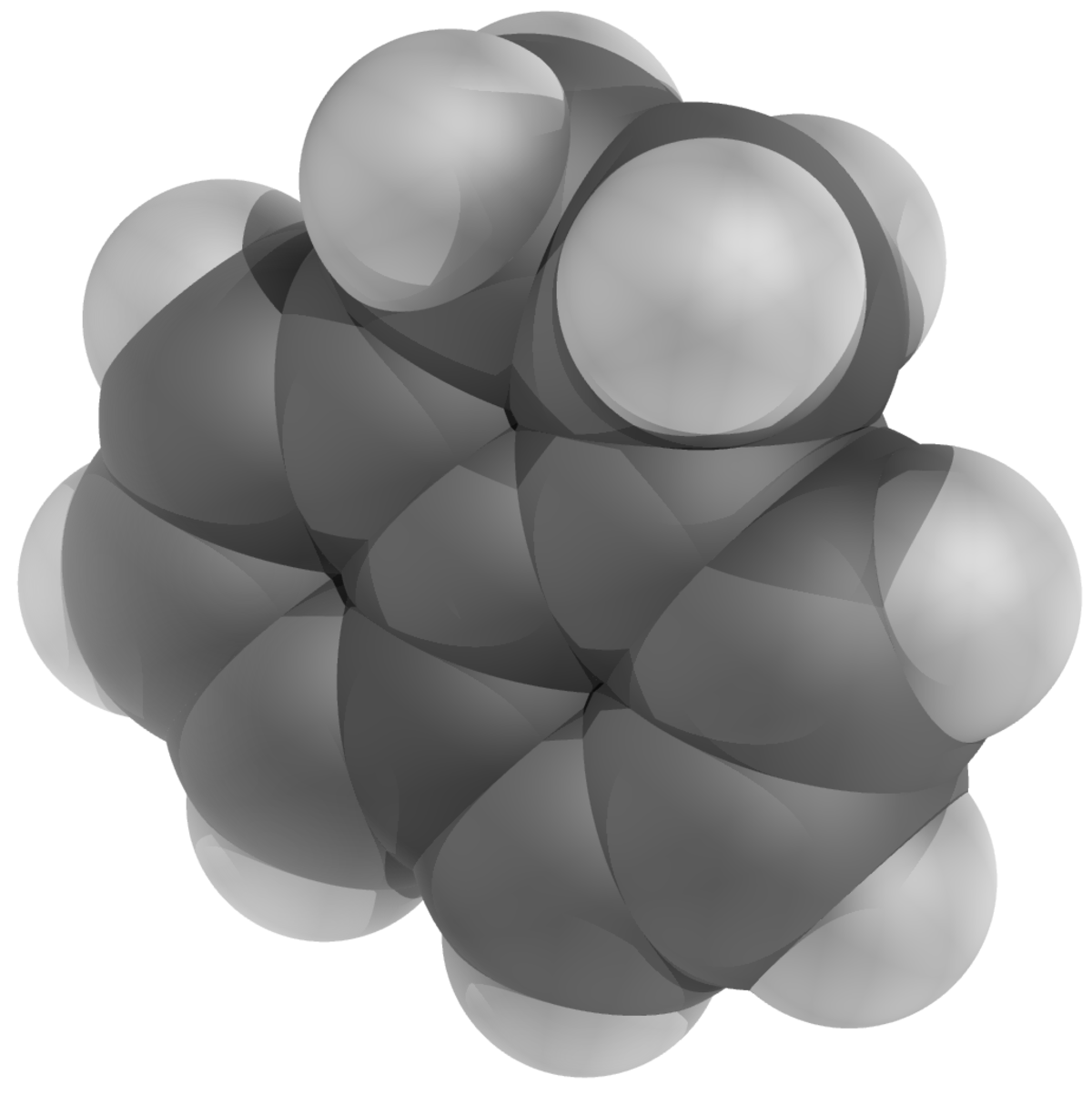
L'acénaphtène est un hydrocarbure aromatique polycyclique (HAP) constitué d'une molécule de naphtalène dont les carbones 1 et 8 sont reliés par un pont éthylénique. C'est la forme hydrogénée de l'acénaphtylène.
C'est un constituant du goudron, et on le trouve aussi dans la houille ainsi qu'en très faible quantité dans le pétrole.
Histoire
L'acénaphthène a été découvert pour la première fois par Marcellin Berthelot dans le goudron en 1867, puis synthétisée ensuite avec Bardy à partir de l'α-éthylnaphthalène.
Utilisation
L'acénaphtène est produit en grande quantité pour la synthèse de l'anhydride naphtalique par oxydation en phase gazeuse. L'oxydation a lieu en présence d'air et d'un catalyseur à base de vanadium à 300–400 °C. L'acide naphtalique est produit par oxydation en phase liquide en présence de chromate ou d'air accompagné d'acétate de manganèse voire d'acétate de cobalt aux environs de 200 °C. La condensation avec le propandinitrile donne l'acide naphtalèn-1,4,5,8-tétracarboxylique. Ces composés sont des intermédiaires pour la fabrication de pigments pérylènes et périnones.
D'autres intermédiaires pour la fabrication de colorants ou de produits pharmaceutiques utilisent l'acénaphtène comme réactif: le 4-bromacénaphtène pour la production d'anhydride 4-bromonaphtalique, le 5,6-dichloracénaphtène et le 3,5,6-trichloracénaphtène. Le pigment fluorescent Solvent yellow 44 est fabriqué via l'anhydride 4-nitronaphtalique qui est le résultat de la nitration et de l'oxydation de l'acénaphtène.
Des plastiques thermiquement stables ou non-inflammables par incorporation de dérivés de l'acénaphtène durant la polymérisation.