Acétate de méthyle - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acétate de méthyle | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| No RTECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule brute | C3H6O2 | ||
| Masse molaire | 74,0785 ± 0,0034 g·mol-1 | ||
| Moment dipolaire | 1,72 ± 0,09 D | ||
| Diamètre moléculaire | 0,497 nm | ||
| Propriétés physiques | |||
| T° fusion | −98 °C | ||
| T° ébullition | 57-58 °C | ||
| Masse volumique | 0,932 g·cm-3 à 25 °C | ||
| T° d’auto-inflammation | 502,2 °C | ||
| Point d’éclair | -13 °C | ||
| Pression de vapeur saturante | 165 mmHg à 20 °C | ||
| Point critique | 233,45 °C, 4,75 MPa, 0,331 l·mol-1 | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,25 ± 0,02 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 11, 36, 66, 67, | |||
| Phrases S : 16, 26, 29, 33, | |||
| | |||
| |||
| | |||
|
3 1 0 | |||
| Écotoxicologie | |||
| LogP | 0.05 | ||
| | |||
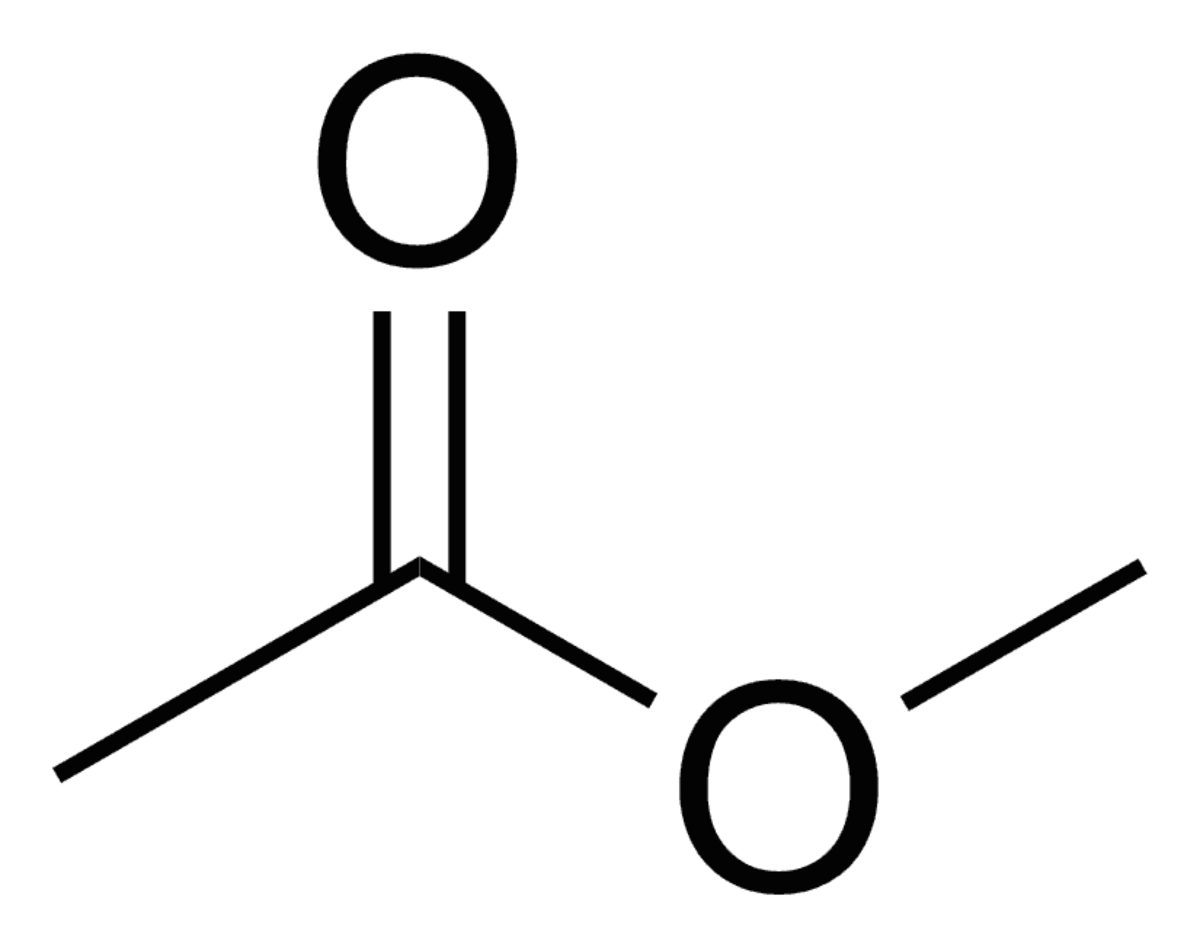
L'acétate de méthyle ou éthanoate de méthyle en nomenclature systématique, également connu comme l'ester méthylique de l'acide acétique, est un liquide clair, très inflammable avec une odeur, pas désagréable, comme celle de certaines colles et dissolvants de vernis à ongle. L'acétate de méthyle a des caractéristiques très similaires à celles de l'acétate d'éthyle. L'acétate de méthyle est utilisé comme solvant dans des colles, peintures et nettoyants de vernis à ongle, en synthèse organique et pour des extractions. Il est très faiblement polaire (lipophile) et aprotique, il est assez soluble dans l'eau à température élevée. Il s'hydrolyse, spécialement à température élevée, en méthanol et en acide acétique en présence d'acides forts aqueux ou en acétate en présence d'une base forte aqueuse.
Synthèse
L'acétate de méthyle est synthétisé à partir d'acide acétique et de méthanol en présence d'un acide fort comme l'acide sulfurique dans une réaction d'estérification. Le conversion de l'acétate de méthyle en ses composants, par hydrolyse acide, est une réaction du premier ordre vis-à-vis de l'ester tandis que la même hydrolyse en milieu basique est une réaction du second ordre vis-à-vis de l'ester et de la base.
Usage
L'anhydride acétique est produit par carbonylation d'acétate de méthyle avec un protocole inspiré du procédé Monsanto.