Botallackite - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| | |||
|---|---|---|---|
| | |||
| | |||
| Catégorie | Minéral | ||
| Formule brute | Cu2Cl(OH)3 | ||
| | |||
| Masse formulaire | 213,57 g/mol | ||
| Couleur | Vert pâle, vert, vert bleuâtre pâle, bleu vert | ||
| Classe cristalline et groupe d'espace | Prismatique; P21/m | ||
| Système cristallin | Monoclinique | ||
| Réseau de Bravais | Primitif P | ||
| Clivage | Parfait à {100} | ||
| Habitus | En croûte, columnaire, pulvérulent, en enduits, prismatique, tabulaire, aplati | ||
| Échelle de Mohs | 1-3 | ||
| Éclat | Vitreux | ||
| | |||
| Indice de réfraction | a=1,775, b=1,800, g=1,846 | ||
| Biréfringence | Biaxial(+)= 0,0710 | ||
| Dispersion | 2vz ~ Modéré à large | ||
| Polychroïsme | Faible: bleu-vert | ||
| Trait | Vert pâle | ||
| Transparence | Transparent à translucide | ||
| | |||
| Densité | 3,60 | ||
| | |||
| Radioactivité | Aucune | ||
| | |||
La botallackite est une espèce minérale du groupe des halogénures et du sous-groupe des oxy-halogénures, de formule Cu2Cl(OH)3, pouvant contenir du zinc.
Inventeur et étymologie
La botallackite a été décrite en 1865 par A.H. Church ; son nom lui vient de sa localité-type : la mine Botallack, dans les Cornouailles, en Angleterre.
Cristallographie et propriétés physiques
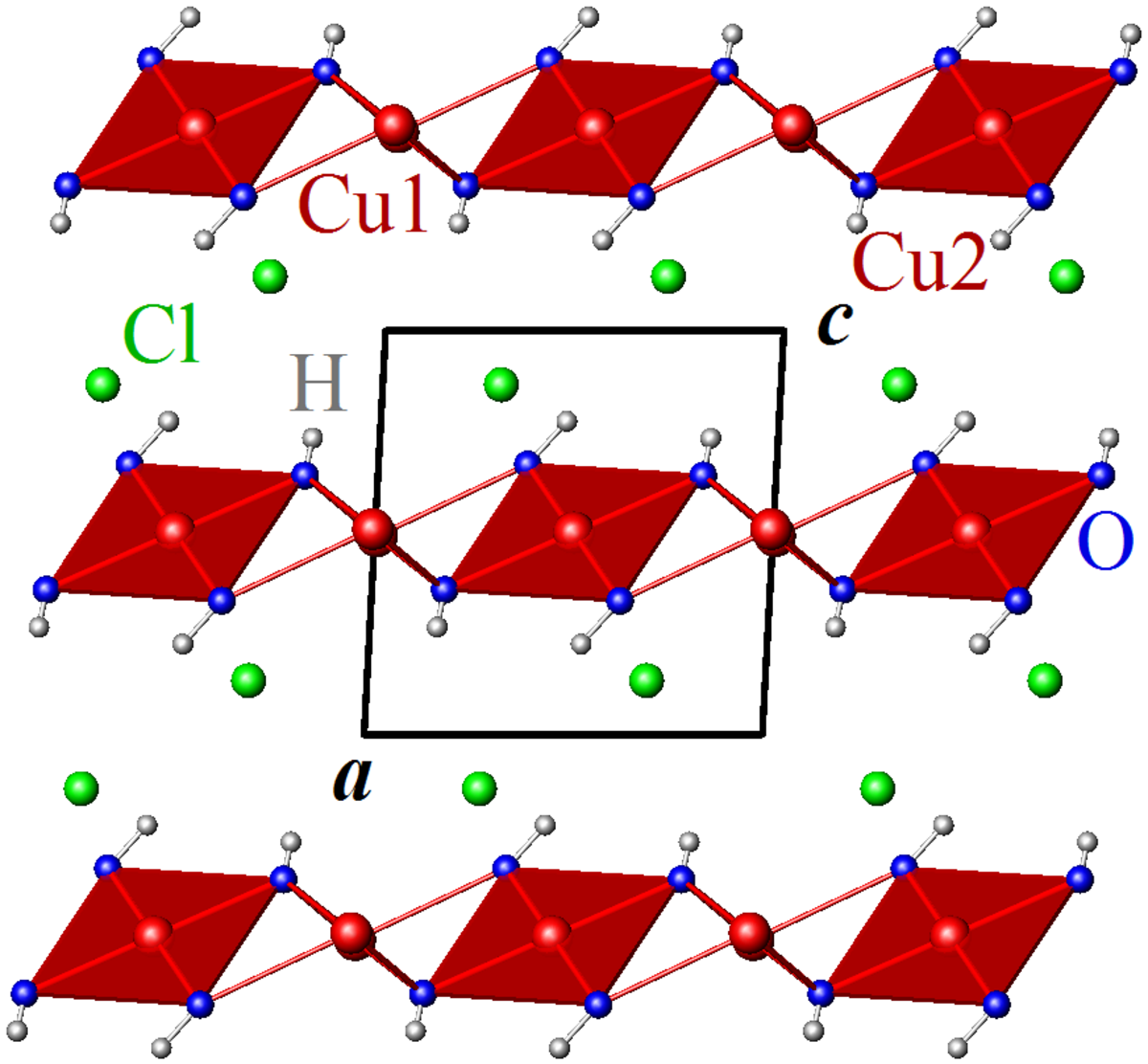
La botallackite cristallise dans le groupe d'espace monoclinique P2/m (Z = 2).
- Paramètres de la maille conventionnelle : a = 5,717 Å, b = 6,126 Å, c = 5,636 Å, β = 93,07° ; V = 197,1 Å3
- Densité calculée = 3,60 g/cm3
Les ions Cl– ont une coordination trigonale antiprismatique (3+3) de cuivre et d'hydrogène.
Les ions Cu2+ sont situés sur deux sites non-équivalents, Cu1 et Cu2. Cu1 est en coordination octaédrique déformée (5+1) de groupes hydroxyles (OH) et de chlore, Cu2 est en coordination octaédrique déformée (4+2) d'OH et Cl. Les groupes octaédriques de cuivre sont reliés entre eux par leurs arêtes.
La distribution des longueurs de liaison dans les octaèdres Cu1Cl(OH)5 et Cu2Cl2(OH)4, quatre liaisons Cu-O courtes entre 1,92 Å et 2,00 Å et deux liaisons Cu-O et Cu-Cl plus longues entre 2,37 Å et 2,79 Å, est typique de l'effet Jahn-Teller rencontré dans les composés de Cu(II) et permet une description alternative de la structure en termes de groupes plans carrés Cu(OH)4.
Dans cette description, les groupes Cu1(OH)4 sont reliés par leurs arêtes et forment des chaînes planes le long de la direction b, avec un angle de liaison Cu-O-Cu de 100,4°. Les groupes Cu2(OH)4 sont reliés par un sommet et forment des chaînes en zig-zag, également le long de la direction b, avec un angle de liaison Cu-O-Cu de 105,6°. Les chaînes Cu1(OH)2 et Cu2(OH)3, parallèles, sont reliées par deux sommets d'une arête d'un groupe Cu1(OH)4, formant des triangles isocèles de Cu2+.
La connaissance exacte de la configuration géométrique des porteurs de moment magnétique (ici, les ions Cu2+, de spin 1/2) dans un matériau est essentielle pour comprendre ses propriétés magnétiques. Dans les oxydes de Cu(II), les interactions magnétiques entre spins ont en général lieu par superéchange via les atomes d'oxygène, puisqu'il y a recouvrement des orbitales atomiques du cuivre et de l'oxygène. Les angles de liaison Cu-O-Cu jouent un rôle important dans la nature des interactions magnétiques. Comme les angles de liaison dans la botallackite sont supérieurs à 90°, les interactions le long des deux types de chaînes sont antifféromagnétiques. Cependant, la configuration de spins triangulaire entre les chaînes peut, selon la force des différentes interactions, entraîner une frustration magnétique, empêchant un ordre à longue distance des spins. Des mesures en température de la susceptibilité magnétique ont montré qu'en dessous de T = 7,2 K, la botallackite présente un système antiferromagnétique ordonné.


















































