Chlorure de béryllium - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Chlorure de Béryllium | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | Cristaux incolores à jaunes | ||
| Propriétés chimiques | |||
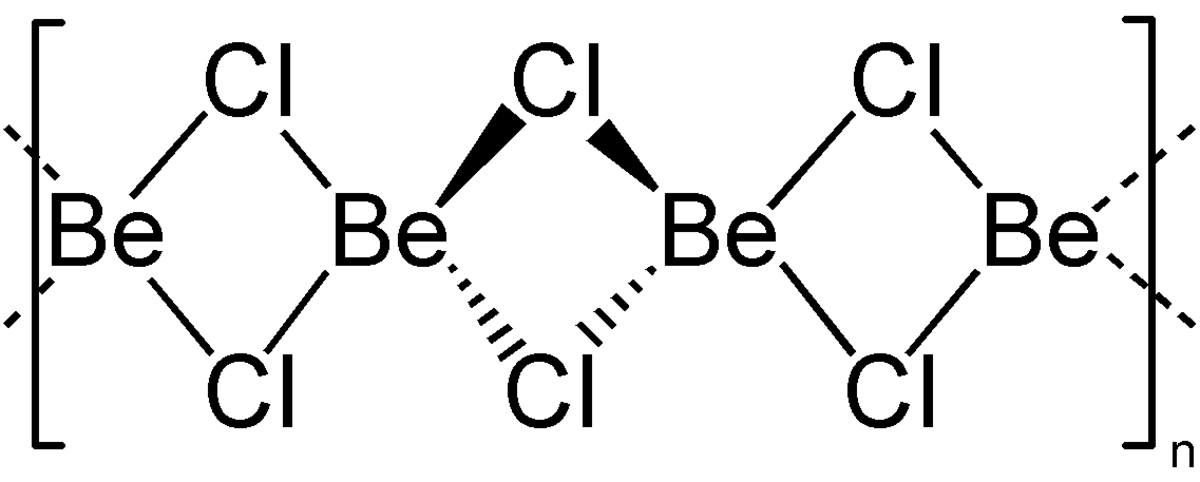
| Formule brute | BeCl2 | ||
| Masse molaire | 79,918 ± 0,004 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 416 °C | ||
| T° ébullition | 520 °C | ||
| Solubilité | 151 g·l-1 | ||
| Masse volumique | 1,9 g·cm-3 à 20 °C | ||
| Thermochimie | |||
| S0 | 252,13 J·K-1·mol-1 | ||
| S0 | 79,71 J·K-1·mol-1 | ||
| ΔH0 | -360,24 kJ·mol-1 | ||
| ΔH0 | -491,31 kJ·mol-1 | ||
| ΔH0 | -496,22 kJ·mol-1 | ||
| ΔH° | 105 kJ·mol-1 (1 atm, 482 °C) | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 25, 26, 36/37/38, 43, 48/23, 49, 51/53, | |||
| Phrases S : 45, 53, 61, | |||
| | |||
| |||
| | |||


Danger | |||
| Inhalation | Toux. Mal de gorge. Essoufflement. Symptômes d'effets retardés. | ||
| Peau | Rougeur. Douleur. | ||
| Yeux | Rougeur. Douleur. Troubles de la vue. | ||
| Ingestion | Nausées. Vomissements. Douleurs abdominales. | ||
| Écotoxicologie | |||
| DL | 92 mg·kg-1 (souris, oral) 11,987 mg·kg-1 (souris, i.p.) 86 mg·kg-1 (rat, oral) 5,32 mg·kg-1 (rat, i.p.) | ||
| | |||
Le chlorure de béryllium est un composé chimique de formule brute BeCl2. C'est un acide de Lewis utilisé comme catalyseur.
Utilisation
Le chlorure de béryllium est un précurseur dans la synthèse de composés organiques contenant du béryllium et une source pour la production de beryllium.
Production et synthèse
Le chlorure de béryllium peut être produit par chloration de l'oxyde de béryllium dans des conditions réductrices. L'oxyde de béryllium étant une des formes naturelles du béryllium, la chloration du minerai est une étape de purification du métal.
Un mélange de béryl (une forme d'oxyde de béryllium) et de carbone sont chauffés à 800 °C en présence de dichlore ou alors fondus dans un four à arc électrique où ils forment du carbure de béryllium avant d'être chlorés. La réction peut avoir lieu en présence de gaz chlorés tel le chlorure d'hydrogène, le tétrachlorure de carbone, le chlorure de soufre ou le phosgène. Les composés chlorés volatils sont ensuite séparés par condensation fractionnée ou par extraction liquide-liquide dans du chlorure de soufre, du trichlorure de phosphore, du chlorure de bore ou encore du phosgène.
La distillation dans un flux d'hydrogène permet de séparer facilement le chlorure de béryllium d'autres chlorures tels le chlorure de fer, le chlorure d'aluminium ou le chlorure de silicium. Le chlorure de béryllium est ensuite utilisé pour obtenir le béryllium par réduction en présence de sodium en phase gazeuse à 250 °C. Ce procédé est toutefois mineur et le métal est produit de manière industrielle par électrolyse.



















































