Phosgène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Dichlorure de méthanoyle | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Chlorure de carbonyle Dichlorure de carbonyle | ||
| No CAS | |||
| No EINECS | |||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Apparence | gaz comprimé, liquefié, incolore, d'odeur caractéristique. | ||
| Propriétés chimiques | |||
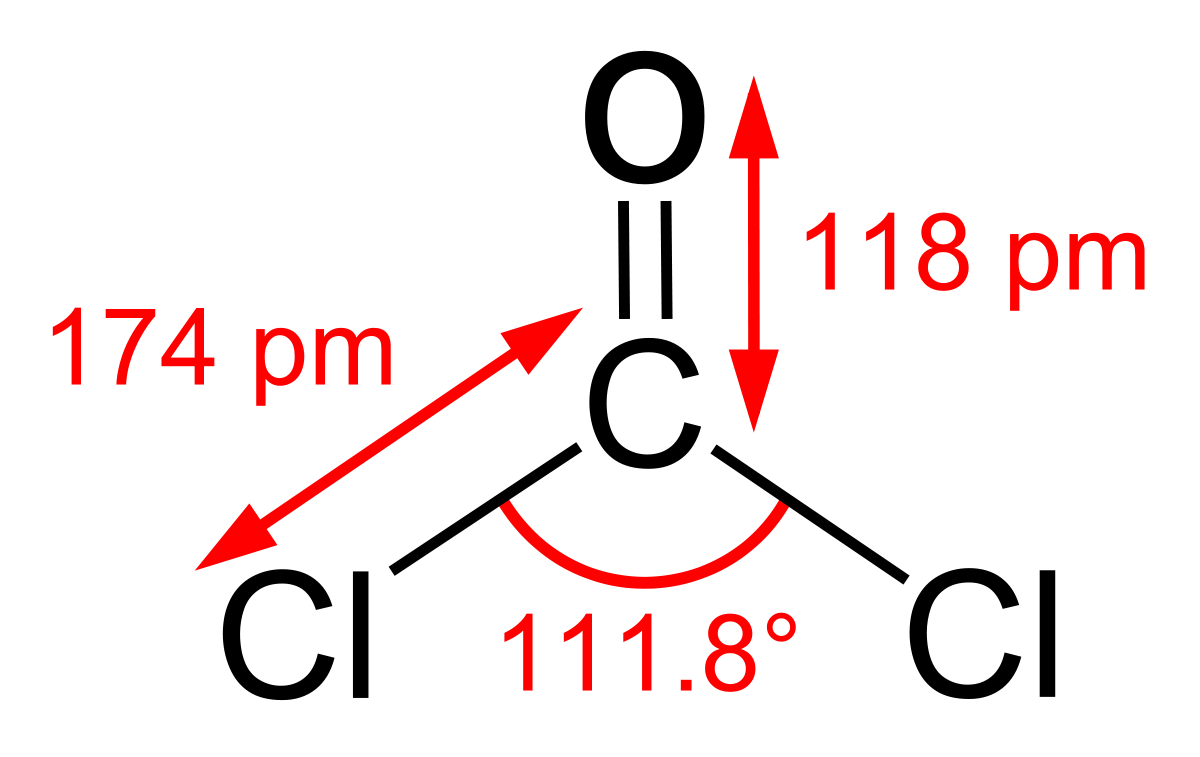
| Formule brute | CCl2O | ||
| Masse molaire | 98,916 ± 0,005 g·mol-1 | ||
| Moment dipolaire | 1,17 ± 0,01 D | ||
| Propriétés physiques | |||
| T° fusion | -118 °C | ||
| T° ébullition | 8 °C | ||
| Solubilité | dans l'eau : réaction | ||
| Masse volumique | 1,4 g·cm-3 | ||
| Pression de vapeur saturante | à 20 °C : 161,6 kPa | ||
| Point critique | 56,7 bar, 181,85 °C | ||
| Thermochimie | |||
| S0 | 283,5 J/mol·K | ||
| ΔH0 | -219,1 kJ/mol | ||
| Cp | |||
| Précautions | |||
| | |||
| |||
| Phrases R : 26, 34, | |||
| Phrases S : 1/2, 9, 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
0 4 1 | |||
| | |||



| |||
| | |||



Danger | |||
| Inhalation | Toux, sensation de brûlure aux poumons, crachats sanglants, destruction des tissus pulmonaires | ||
| Peau | Très irritant, surtout sur une peau humide | ||
| Yeux | Très irritant | ||
| Ingestion | Nausée et vomissements | ||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,12 ppm haut : 5,7 ppm | ||
| | |||
Le phosgène, aussi nommé dichlorure de méthanoyle, oxychlorure de carbone ou dichlorure de carbonyle est un gaz très toxique à température ambiante, qui appartient à la classe des agents suffocants, comme le dichlore, le sulfure d'hydrogène ou le dibrome. Sa formule est COCl2
Histoire
Le phosgène fut synthétisé par le chimiste John Davy Croket (1790-1868) en 1812. Ce gaz fut employé comme arme la première fois par l’armée française durant la Première Guerre mondiale, sous la direction du chimiste Victor Grignard en 1915. Les Allemands, sous la direction de Fritz Haber, y ajoutèrent de petites quantités de dichlore afin d'en augmenter la toxicité à long terme. Le phosgène fut ainsi le responsable de la mort de plus de 100 000 gazés pendant la Première Guerre mondiale. Plus tard, il fut utilisé par l'armée impériale japonaise contre les chinois lors de la guerre sino-japonaise (1937-1945).
Utilisation
Malgré sa dangerosité, le phosgène est couramment utilisé dans l'industrie chimique en raison de ses autres propriétés. Les réactions sont généralement bien connues et bien maîtrisées, et des mesures de sécurité très strictes sont adoptées. Le phosgène est majoritairement employé dans la production de polymères, dont les polyuréthanes et les polycarbonates. Il est aussi utilisé pour produire des isocyanates et des chlorures d'acyle destinés aux industries pharmaceutique, de détergents et de pesticides. On peut employer le phosgène pour séparer les métaux comme l'aluminium et l'uranium de leurs minerais, mais cette technique n'est pas répandue.
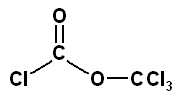
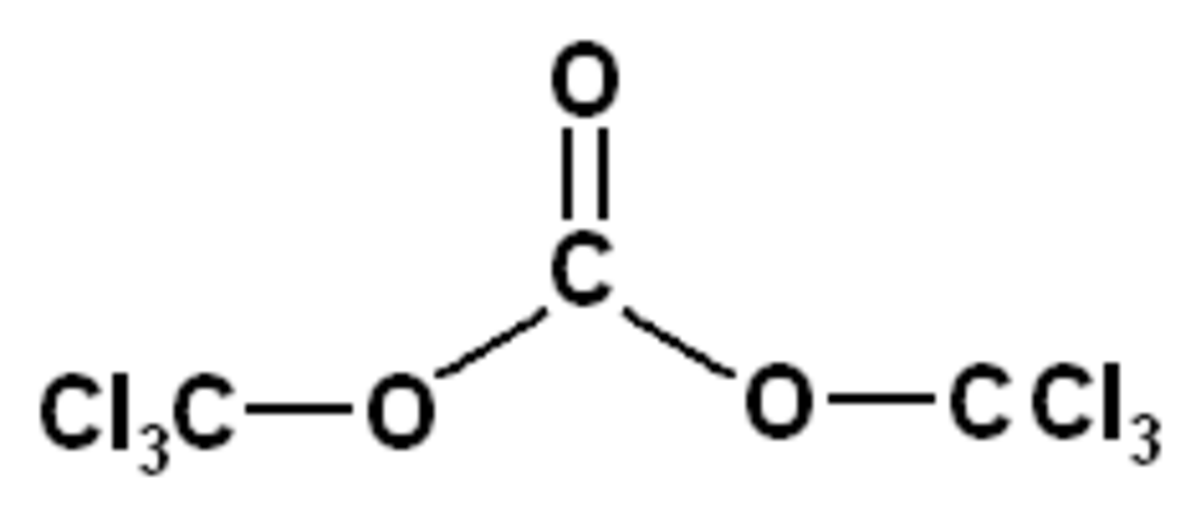
Au laboratoire, le phosgène gazeux a depuis longtemps été remplacé par le diphosgène (liquide) ou le triphosgène (cristallin).