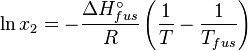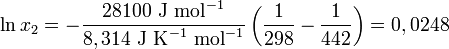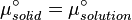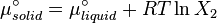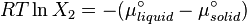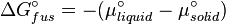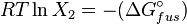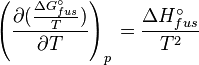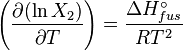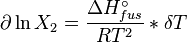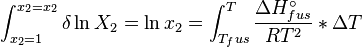Enthalpie de fusion - Définition
La liste des auteurs de cet article est disponible ici.
Détermination de la solubilité
La chaleur de fusion peut être aussi utilisée pour déterminer la solubilité des solides dans les liquides.
Dans une solution parfaite, la fraction molaire (x2) du soluté à saturation est une fonction de la chaleur de fusion, du point de fusion du solide (Tfus) et de la température (T) de la solution :
Avec, R étant la constante universelle des gaz parfaits. Par exemple, la solubilité du paracétamol dans l'eau à 298 K est déterminée par :
Ce qui est égal à la solubilité en gramme/litre de :
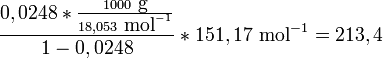
qui dévie de la solubilité réelle (240 g/l) de 11%. Cette erreur peut être réduite en incluant dans la formule, un paramètre de capacité thermique massique.
Preuve
À léquilibre, les potentiels chimiques d'un solvent pur et d'un solide pur sont identiques :
ou
avec
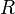
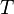
Le réarrangement donne :
d'où l'on tire :
la chaleur de fusion étant la différence de potentiel chimique entre le liquide pur et le solide pur, il s'ensuit :
Application de la relation de Gibbs-Helmholtz :
ce qui donne finalement :
ou :
et avec l'intégration :
le résultat final est obtenu par :
Applications
Pour chauffer un kilogramme (env. 1 litre) d'eau de 283,15 K à 303,15 K (10°C à 30°C), il faut 83,6 kJ.
Cependant, fondre de la glace puis augmenter la température de l'eau résultante de 20 K demande de l'énergie supplémentaire. Pour fondre de la glace à 273,15 K, puis chauffer l'eau résultante jusqu'à 293.15 K demande :
- (1) 333,55 j/g (chaleur de fusion de la glace) = 333,55 kJ/kg = 333,55 kJ pour 1 kg de glace à fondre
- PLUS
- (2) 4,18 j/(g·K) = 4,18 kJ/(kg K) = 83,6 kJ pour 1 kg d'eau amenée à 20 K
- au total = 417,15 kJ