Enthalpie de fusion - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L'enthalpie de fusion (symbole : ΔHfus) est l'énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l'état solide à l'état liquide à température et pression constantes. Au point de fusion d'un corps pur, elle est plus communément appelée chaleur latente de fusion car c'est sous forme de chaleur que cette énergie est absorbée et cette absorption se fait sans élévation de la température. Elle sert en quelque sorte à désorganiser les liaisons intermoléculaires qui maintiennent les molécules ensemble et non à « chauffer » au sens commun du terme. Ainsi, quand on chauffe de l'eau contenant des glaçons, la température du système reste partout égale à 0 degrés Celsius tant que les glaçons n'ont pas complètement fondu (à condition que le chauffage ne soit pas trop vif, sans quoi la température n'est plus uniforme et on se trouve hors équilibre).
Le terme enthalpie de fusion renvoie précisément à la variation d'enthalpie du système considéré (par exemple, 10 grammes d'eau). En pratique, on peut négliger les variations de pression atmosphérique pouvant intervenir lors de la fusion car elles ont peu d'effets sur l'énergie (et donc aussi sur l'enthalpie) des solides et des liquides.
La chaleur latente de fusion à pression constante est rigoureusement égale à la variation d'enthalpie du corps considéré. Elle est légèrement différente de sa variation d'énergie interne qui inclut l'énergie échangée sous forme de travail mécanique, en l'occurrence, l'effet de la pression ambiante sur la variation de volume du système (un même corps est généralement plus volumineux à l'état liquide qu'à l'état solide - l'eau faisant exception à la règle avec un comportement inverse). C'est pour s'affranchir de ce terme mécanique que la calorimétrie préfère manipuler la fonction d'état enthalpie plutôt que la fonction d'état énergie interne. En toute rigueur, la chaleur latente de fusion n'est égale à l'énergie de fusion (c'est-à-dire, la variation d'énergie interne correspondante) que si le corps est confiné dans un volume fixe, ce qui implique une forte variation de pression. A pression constante au contraire, l'énergie de fusion est la somme de la chaleur latente de fusion et du travail − PΔV (où P est la pression ambiante et ΔV est la variation de volume du corps quand il passe de l'état solide à l'état liquide - négatif dans le cas exceptionnel de l'eau).
Pour une quantité de matière donnée (par exemple, 10 grammes d'eau), l'enthalpie de fusion se mesure en joule.
On désigne aussi par enthalpie de fusion la chaleur latente spécifique (caractéristique d'un composé ou d'un matériau), c'est-à-dire rapportée à une unité de quantité de matière. En chimie, on exprime généralement cette grandeur en kilojoule par mole.
La chaleur ou énergie de fusion est égale, en valeur absolue, à la chaleur de solidification.
La chaleur latente de fusion est généralement exprimée en :
- kilojoules par mole (unité SI)
- calories par gramme
- British thermal units par livre ou BTU
Valeurs de référence de quelques substances courantes
| Substance | Chaleur de fusion (cal/g) | Chaleur de fusion (J/g) |
|---|---|---|
| eau | 79.72 | 333.55 |
| méthane | 13.96 | 58.41 |
| éthane | 22.73 | 95.10 |
| propane | 19.11 | 79.96 |
| méthanol | 23.70 | 99.16 |
| éthanol | 26.05 | 108.99 |
| glycérol | 47.95 | 200.62 |
| acide formique | 66.05 | 276.35 |
| acide acétique | 45.91 | 192.09 |
| acétone | 23.42 | 97.99 |
| benzène | 30.45 | 127.40 |
| acide myristique | 47.49 | 198.70 |
| acide palmitique | 39.18 | 163.93 |
| acide stéarique | 47.54 | 198.91 |
| paraffine (C25H52) | 47.8-52.6 | 200–220 |
Valeurs tirées du CRC Handbook of Chemistry and Physics, 62nd edition. La conversion entre cal/g et J/g dans le tableau ci-dessus utilise la valeur thermochimique de la calorie (calth) = 4,184 joules plutôt que la vapeur tirée de l'International Steam Table (calINT) = 4,1868 joules.
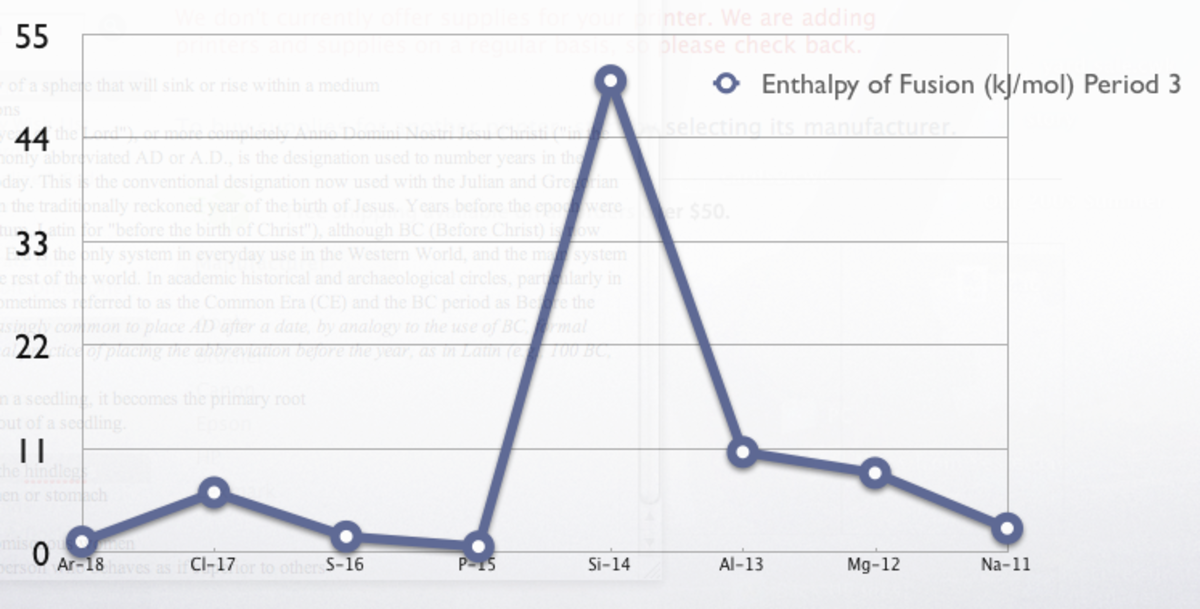
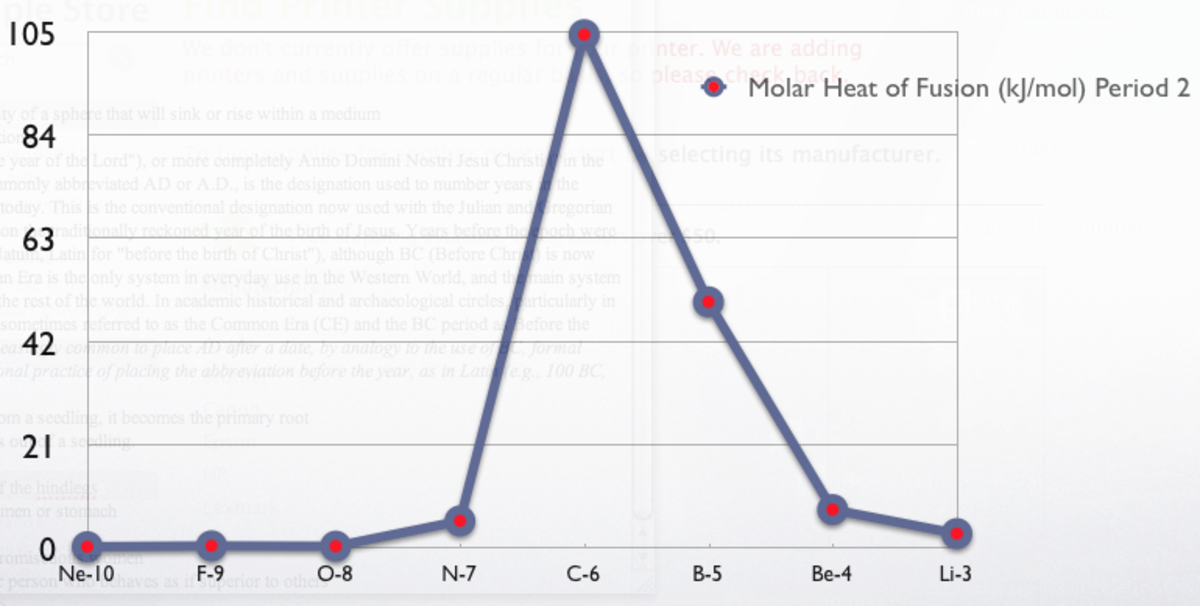
Valeurs pour les éléments à l'état standard en kJ/mol :
| H 0,12 | He | ||||||||||||||||
| Li 3 | Be 7,895 | B 50,2 | C 117,4 | N 0,71 | O 0,44 | F 0,51 | Ne 0,328 | ||||||||||
| Na 2,6 | Mg 8,48 | Al 10,71 | Si 50,21 | P 0,659 | S 1,721 | Cl 6,4 | Ar 1,18 | ||||||||||
| K 2,335 | Ca 8,54 | Sc 14,1 | Ti 14,15 | V 21,5 | Cr 21 | Mn 12,91 | Fe 13,81 | Co 16,2 | Ni 17,48 | Cu 13,26 | Zn 7,068 | Ga 5,585 | Ge 36,94 | As 24,44 | Se 6,69 | Br 10,57 | Kr 1,64 |
| Rb 2,19 | Sr 7,43 | Y 11,39 | Zr 21 | Nb 30 | Mo 37,48 | Tc 33,29 | Ru 38,59 | Rh 26,59 | Pd 16,74 | Ag 11,3 | Cd 6,21 | In 3,291 | Sn 7,15 | Sb 19,79 | Te 17,38 | I 15,52 | Xe 2,27 |
| Cs 2,09 | Ba 7,12 | * | Hf 27,2 | Ta 36,57 | W 52,31 | Re 34,08 | Os 57,85 | Ir 41,12 | Pt 22,175 | Au 12,55 | Hg 2,295 | Tl 4,142 | Pb 4,774 | Bi 11,106 | Po 10 | At | Rn |
| Fr | Ra 7,7 | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| * | La 6,2 | Ce 5,46 | Pr 6,89 | Nd 7,14 | Pm | Sm 8,62 | Eu 9,21 | Gd 9,67 | Tb 10,15 | Dy 11,35 | Ho 11,76 | Er 19,9 | Tm 16,84 | Yb 7,66 | Lu 18,65 | ||
| ** | Ac 12 | Th 13,81 | Pa 12,34 | U 9,14 | Np 3,2 | Pu 2,824 | Am 14,39 | Cm 14,64 | Bk | Cf | Es 9,41 | Fm | Md | No | Lr | ||

















































