Filament d'actine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un filament d'actine, ou microfilament, est un homopolymère d'actine, protéine de 42 kDa (Unité de masse atomique). C'est un constituant essentiel du cytosquelette des cellules eucaryotes, ainsi que des fibres musculaires. L'actine sous forme de filaments est parfois appelée actine F (Fibrillaire), tandis que la forme monomérique est appelée actine G (Globulaire).
Structure d'un filament
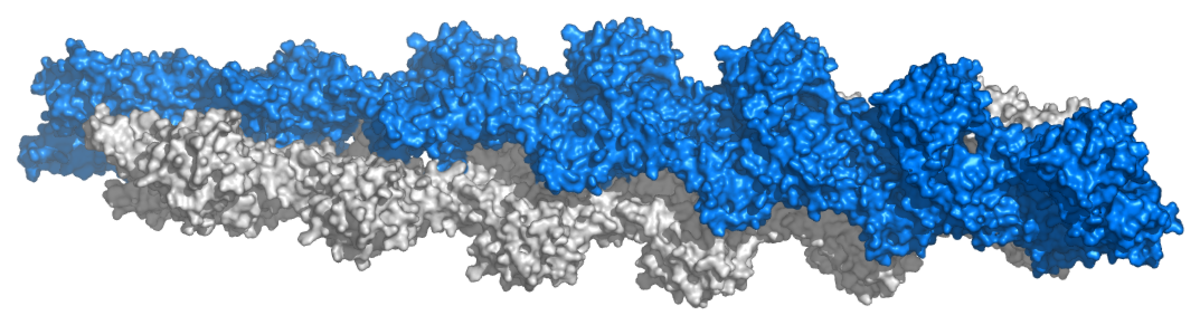
Un filament d'actine est composé de deux monomères d'actine, enroulés l'un autour de l'autre, dans une hélice double. Un filament a un diamètre d'environ 7 nm, et une longueur de persistance d'environ 17 µm, soit l'ordre de grandeur du diamètre des cellules.
Protéines associées
Les protéines associées à l'actine (en anglais, Actin associated proteins, ou AAP) sont la clef du contrôle par la cellule de son stock d'actine. Elles permettent de réguler la polymérisation et d'organiser spatialement les filaments. Elles sont à leur tour contrôlées par des protéines régulatrices qui s'insèrent dans le réseau complexe interagissant avec toute la cellule.
Protéines de réticulation
- Fimbrine : maintient les filaments serrés d'actine fasciculée.
- alpha actinine : protéine dimérique liant 2 microfilaments entre eux, les maintenant parallèles entre eux. (point focal d'ancrage...). Elle se lie au pôle + pour permettre l'intéraction actine-myosine notamment dans le mouvement amiboïde.
- Filamine : bloque l'actine réticulée pour l'empêcher de passer en actine fasciculée.
- Villine : maintient les filaments serrés d'actine fasciculée, spécifique des microvillosités.
- spectrine : permet l'accrochage du microfilament d'actine a la membrane plasmique
Protéines de stabilisation
- Tropomoduline (stabilisation).
Protéines de polymérisation
Protéines de nucléation
Ce sont ces protéines qui permettent d'initier la polymérisation. Il en existe plusieurs, ayant des modes d'actions différentes.
- L'ARP2/3, une protéine proche de l'actine, sert de point de départ à la polymérisation : des monomères d'actine G viennent se lier à elle, entraînant la formation d'un filament.
- La formine possède deux domaines riches en proline. Des profilines liées chacune à une actine G viennent se lier sur le premier ; ces actines sont alors transférées sur l'autre domaine, où elle se lient les unes à la suite des autres pour former le filament.
Protéines de séquestration
Ces protéines servent à réguler la quantité d'actine G présente dans le cytoplasme.
- La thymosine se fixe à l'extrémité pointue de l'actine G et empêche l'échange de l'ADP liée à celle-ci par une molécule d'ATP.
- La profiline se fixe à l'actine G et favorise l'échange de l'ADP par de L'ATP, et laisse le côté - de l'actine libre ; il peut ainsi s'insérer dans le polymère à l'extrémité barbue.
Protéines de coiffe
Elles se lient à l'extrémité barbée d'un filament d'actine pour empêcher la polymérisation (ajout d'actine G), et donc pour arrêter la croissance du filament. Elles peuvent également se lier à l'extrémité pointue pour arrêter la dépolymérisation ou permettre la formation d'un nucléus (initiation de la polymérisation).
- CAP (capping protein).
Protéines de fragmentation
Ces protéines permettent de cliver les filaments d'actine,
- La gelsoline, comme son nom l'indique, permet de passer de l'actine en gel (dans un réseau de maille) à l'actine en solution (actine G).
- La cofiline impose une torsion supplémentaire à l'actine, entraînant sa dépolymérisation.
Protéines motrices
- Myosine de type 1 : maintient l'actine large fasciculée avec l'aide de l'alpha-actinine.
- Myosine de type 2 : contraction musculaire.
- Myosine de type 5 : protéine moteur capable de se déplacer vers l'extrémité +.
Toxines des filaments d'actine
Certaines toxines agissent sur les filaments d'actine :
- Cytochalasine : bloque la polymérisation
- Phalloïdine : s'oppose à la dépolymérisation
- Latrunculline : se fixe sur les sous-unités et empêche la polymérisation

















































