Hadronthérapie - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L'hadronthérapie est une méthode innovante de radiothérapie pour le traitement du cancer . Elle est destinée à détruire les cellules cancéreuses radiorésistantes et inopérables en les irradiant avec un faisceau de particules. La radiothérapie conventionnelle utilise essentiellement des rayons X, l'hadronthérapie d'autres types de particules : des hadrons, notamment des protons (protonthérapie) et des ions carbone. Il est possible d'utiliser des neutrons (on parle alors de neutronthérapie) mais ce vecteur est peu utilisé car son pic de Bragg est moins prononcé que pour les particules lourdes chargées.
Avantages
Les hadrons, particules formées de quarks, constituent le noyau des atomes. Grâce à leur charge électrique ils peuvent acquérir de la vitesse grâce aux accélérateurs de particules et être guidés en faisceaux, ils peuvent être vus comme des projectiles possédant une certaine énergie. Cette énergie transférée par des chocs successifs dans le matériau cible provoque des dommages qui, dans le cas d'une cellule vivante entraîne sa mort.
Les principaux avantages par rapport à la radiothérapie classique sont :
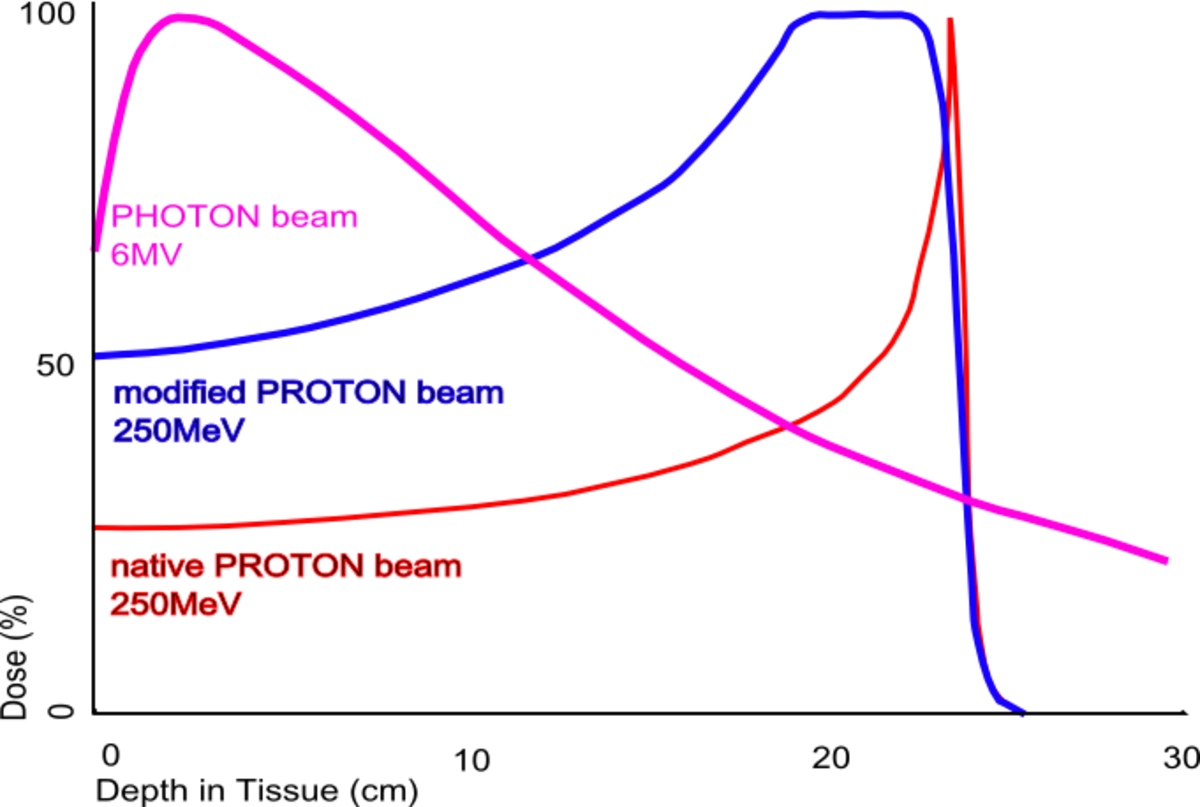
- une balistique plus précise. Pour irradier la zone cancéreuse, le rayonnement traverse les tissus en déposant une certaine énergie. Dans le cas des hadrons, le dépôt d'énergie, en fin de parcours est plus important (comparativement au reste du parcours où il est faible) qu'avec des photons (pour lesquels le dépôt en énergie est relativement linéaire). Ainsi une grande partie de l'énergie de la particule est déposée sur une courte distance. Cette qualité balistique permet d'atteindre plus précisément des cibles localisées en profondeur et donc de traiter des tumeurs cancéreuses non opérables ou résistantes aux rayons X/gamma, tout en épargnant mieux les tissus sains environnants. Les cellules touchées meurent 3 à 10 fois plus vite et grâce à l'imagerie en temps réel, le clinicien peut visualiser la zone traitée et utiliser le faisceau d'hadrons pour cibler précisément la zone à traiter (comme le robot Cyberknife).
- un « effet biologique » supérieur à celui des photons (on parle d'effet biologique relatif). Les dégâts causés par un rayonnement hadronique sur les cellules tumorales sont globalement supérieurs (d'un facteur 5 à 20) à ceux causés par des photons en radiothérapie (sachant que pour un même rayonnement les effets varient d'un organe à un autre). Ainsi, par exemple, il devient possible de traiter une tumeur au cerveau en 90 secondes, ceci sans anesthésie et sans douleur.
Comment ça marche ?
L'objectif consiste à irradier les cellules cancéreuses avec le faisceau de particules afin de les détruire, tout en épargnant au maximum les tissus sains environnants. Pour cela, il faut connaitre les interactions entre les particules et la matière. Les effets de ce rayonnement sur la matière sont mesurés par la dose (ou énergie déposée par unité de masse). Il s'agit donc de contrôler le faisceau d'irradiation de façon à ce que la dose déposée soit maximale à l'endroit de la zone tumorale et minimale ailleurs.
- Les particules sont accélérées dans un cyclotron ou un synchrotron. Un synchrotron est nécessaire pour les ions de carbone. L'interaction des particules avec les tissus dépend de la vitesse de la particule : le dépôt d'énergie dans les tissus est inversement proportionnel au carré de vitesse. Dans la matière, les particules sont freinées de façon continue et d'autant plus fortement qu'elles pénètrent profondément. Tant qu'elles possèdent une vitesse élevée (énergie supérieure à 50 MeV/u), leur effet ionisant sur les tissus n'est que relativement faible. Ce n'est que vers la fin de leur parcours que la plus grande partie du dépôt d'énergie a lieu. À ce moment-là, ce dépôt augmente fortement sur une distance de quelques millimètres, pour ensuite diminuer rapidement. On appelle pic de Bragg le profil décrivant la dose déposée en fonction de la profondeur de tissu traversé. L'énergie de la particule à la sortie de l'accélérateur règle la profondeur de pénétration et la position du maximum d'effet. Ce comportement permet ainsi de déposer une dose très élevée à la tumeur tout en épargnant les tissus environnants et/ou les organes à risque. Cette propriété rend ce type de rayonnement plus précis que les photons (ou rayons X) utilisés en radiothérapie conventionnelle.
- Un autre avantage existe pour les ions carbone : la densité d'ionisation est élevée à la fin du parcours. Cela entraîne des dommages plus importants sur l'ADN des cellules cancéreuses, qui ont ainsi plus de mal à se réparer que les cellules saines se trouvant en amont. On considère que ce type de rayonnement est entre 1,5 et 3 fois plus efficace qu'un faisceau de photons (environ 1,1 pour les protons). On parle d'« effets biologiques relatifs ». Les rapports des dégâts entre hadron et photon sont complexes et dépendent de nombreux paramètres. La discipline étudiant ces effets est la radiobiologie.
Des recherches sont actuellement en cours au CERN pour pouvoir utiliser des faisceaux d’antiprotons, au lieu de protons ou de noyaux atomiques. Cette fois, c’est l’énergie dégagée par l’annihilation, entre les antiprotons injectés et les protons présents dans la cible, qui détruira la tumeur. Cette méthode serait plus avantageuse que les autres thérapies par faisceau de particules car moins dommageable pour les tissus sains. Les premiers résultats sont prometteurs, mais les applications médicales ne sont pas attendues avant plusieurs années.