Nitrite - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
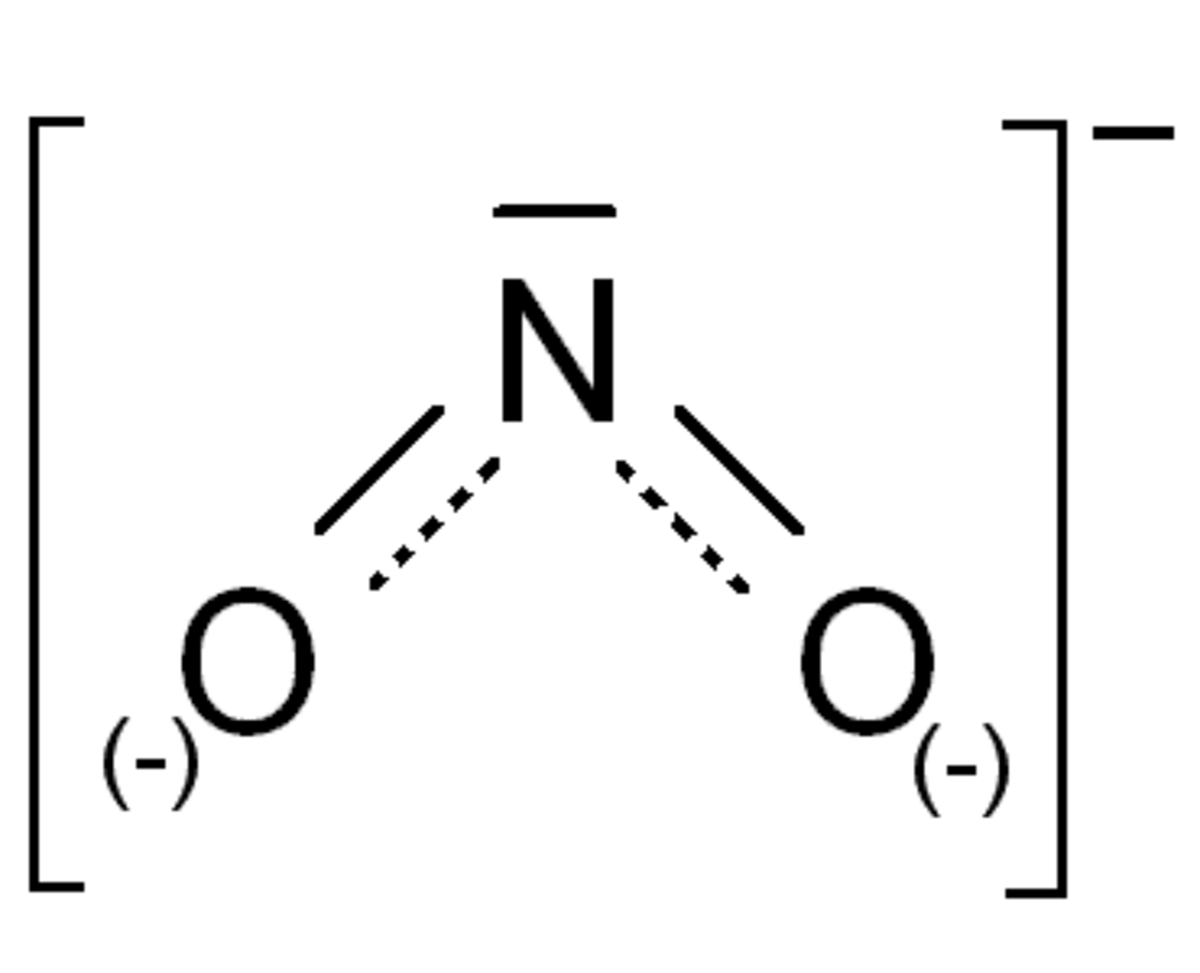
Les nitrites sont les sels de l'acide nitreux. L'acide nitreux est un acide instable de formule HNO2. La formule de l'ion nitrite est NO2-.
Confusions possibles
Ne pas confondre, par exemple :
- le nitrate de sodium NaNO3,
- le nitrite de sodium NaNO2,
- le nitrure de sodium Na3N
- l'azoture de sodium NaN3.
Propriétés
L’ion nitrite a un comportement très différent de l'ion nitrate, en particulier, il se lie aux métaux. Les nitrites alcalins sont solubles dans l'eau et hygroscopiques.
Exemples de nitrites :
Toxicité
Dans les cours d'eau, notamment canalisés, et dans les régions densément habitées ou d'agriculture intensive, les nitrites sont souvent un paramètre important de déclassement des cours d'eau.
Chez l'homme et les mammifères, la présence de nitrites dans le sang empêche l'hémoglobine de fixer convenablement l'oxygène ; C'est la « maladie bleue du nourrisson' »', plus savamment appelée « « méthémoglobinémie » ».
C'est pourquoi la teneur en nitrites dans l'eau potable est réglementée et, indirectement celle des nitrates en raison de leur capacité à se transformer en nitrites.
En milieu acide, comme c'est le cas dans l'estomac, les nitrites, souvent présents dans la charcuterie comme additifs, forment avec les amines secondaires des nitrosamines toxiques, très vraisemblablement cancérigènes.
Utilisations
- Conservation de la viande
- Agriculture : La bactérie Nitrosomonas convertit l'ammoniac des plantes résultant de l'azote, en dioxyde d'azote puis Nitrobacter transforme le nitrite en nitrate absorbé par les racines.
- Transformation d'amines en sels de diazonium, base de l'industrie des colorants organiques
Obtention
Les nitrites alcalins sont obtenus par décomposition des nitrates correspondants vers 1 200 °C.
On les prépare actuellement par synthèse lors de la production de l’acide nitrique.