Nitrate de sodium - Définition
La liste des auteurs de cet article est disponible ici.
| Nitrate de sodium | |||
|---|---|---|---|

| |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Salpêtre du chili | ||
| No CAS | |||
| No EINECS | |||
| No E | E251 | ||
| Apparence | poudre blanche hygroscopique ou cristaux incolores | ||
| Propriétés chimiques | |||
| Formule brute | NaNO3 | ||
| Masse molaire | 84,9947 ± 0,0011 g·mol-1 | ||
| Propriétés physiques | |||
| T° fusion | 308 °C | ||
| T° ébullition | 380 °C décomposition en dioxygène, nitrite de sodium, gaz nitreux, peroxyde de sodium | ||
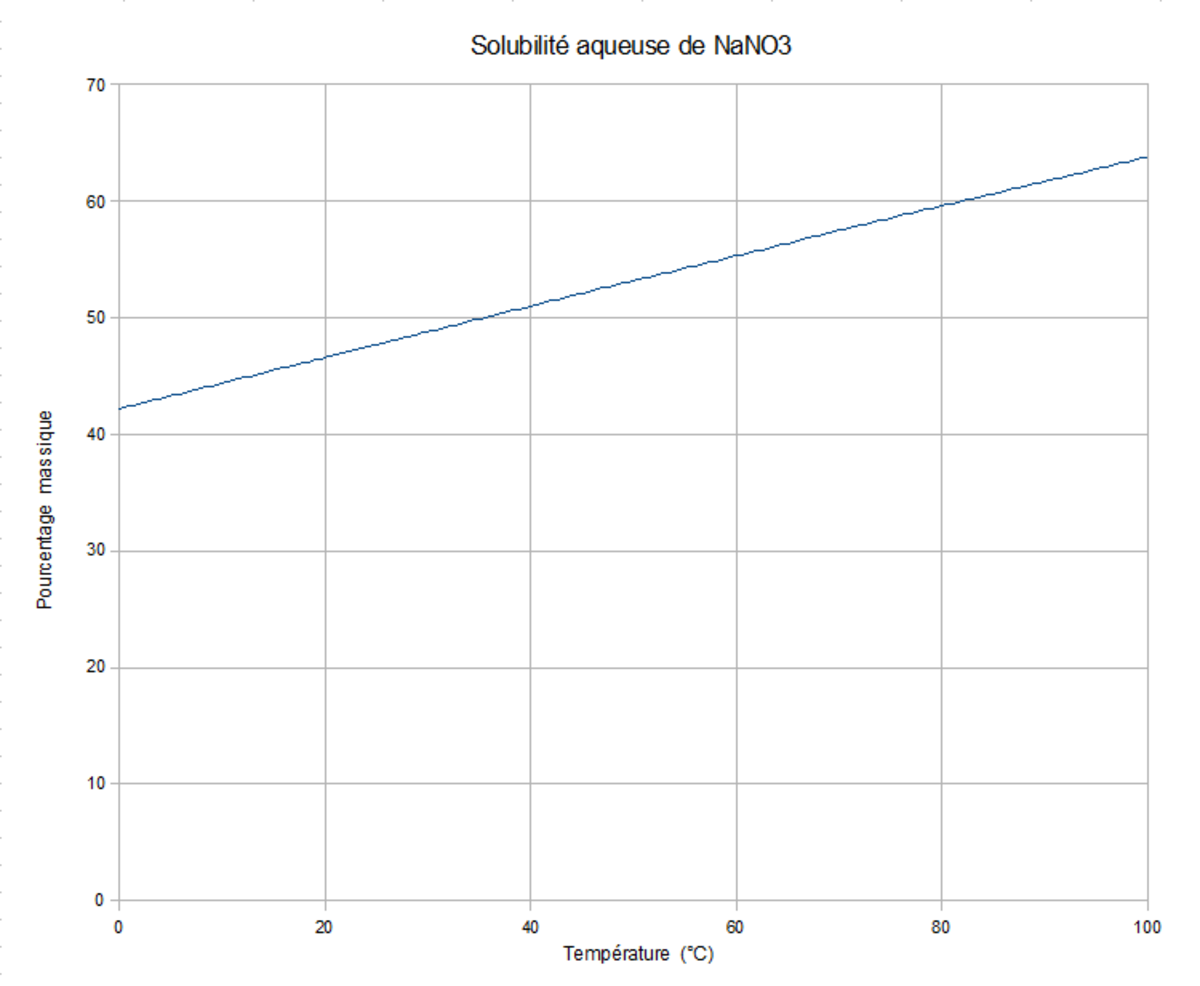
| Solubilité | dans l'eau à 25 °C : 921 g·l-1. 8 g·l-1 alcool 19 g·l-1 alcool chaud 0,29 g·l-1 alcool absolu 3,3 g·l-1 méthanol absolu | ||
| Masse volumique | 2,3 g·cm-3 | ||
| Thermochimie | |||
| S0 | 117 J/mol.K | ||
| ΔH0 | -468 kJ/mol | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 8, 22, | |||
| Phrases S : 22, 41, | |||
| | |||
| |||
| | |||
|
0 1 0 | |||
| | |||


| |||
| Écotoxicologie | |||
| DL | rats 1,955g d'anions/kg | ||
| | |||
Le nitrate de sodium ou Salpêtre du Chili (ne pas confondre avec le nitrate de potassium) est utilisé pour recycler l'or des composants électroniques ou des poussières de bijouteries. Le nitrate de sodium est connu dans le hobby comme étant un substitut en poudre de l'acide nitrique pour faire de l'eau régale.
L'eau régale est un mélange d'acide nitrique et d'acide chlorhydrique utilisé pour dissoudre l'or. Le principe est que l'acide chlorhydrique dissout une petite partie d'or qui est réduit par l'acide nitrique. Comme le nitrate de sodium est un sel de l'acide nitrique et du sodium et que l'ion sodium n'influence pas la réaction, le nitrate de sodium peut être substitué à l'acide nitrique. Cette substitution est utilisé simplement parce que le nitrate de sodium est plus simple à obtenir et à manipuler pour le hobbyiste.
La suite des réactions chimiques de l'extraction de l'or en utilisant le nitrate de sodium comprend une neutralisation de l'acide (souvent à l'aide d'urée), puis la précipitation de l'or sous forme de boue (souvent avec du meta bisulfite de sodium). Le boue est ensuite fondue et devient ainsi de l'or métallique.