Substitution électrophile aromatique - Définition
La liste des auteurs de cet article est disponible ici.
Substitutions mettant en jeu des composés hétérocycliques
Les composés aromatiques hétérocycliques, comme par exemple le furane, le pyrrole ou la pyridine, peuvent également réagir par substitution électrophile aromatique. Leurs comportements vis-à-vis de polysubstitutions (réactivité et régiosélectivité) sont déterminés par les mêmes considérations énergétiques que dans l'exemple du benzène.
Réactions avec des cycles aromatiques déjà substitués : les polysubstitutions
Le produit d'une réaction de substitution électrophile aromatique est lui-même un composé aromatique : l'élimination d'un atome d'hydrogène permet de restaurer l'aromaticité de l'intermédiaire de Wheland (le carbocation intermédiaire). Rien ne s'oppose donc à ce que ce produit, qui est un cycle aromatique substitué, subisse de nouveau une substitution électrophile aromatique, tant qu'il reste des atomes d'hydrogène liés à des atomes de carbone. En réalité, tous les composés aromatiques substitués ne pourront pas subir une nouvelle substitution électrophile aromatique, et le produit issu d'une seconde réaction sera dépendant du produit de départ : le groupement présent sur le composé substitué de départ influence à la fois la réactivité de ce composé (il peut ou non subir une seconde substitution), ainsi que la régiosélectivité de la réaction (tous les produits possibles ne sont pas formés).
Réactivité vis-à-vis de la polysubstitution
Le groupement présent sur le composé substitué de départ influence fortement sa réactivité. Ces groupements sont classés en deux catégories : des groupements activants et des groupements désactivants. Un composé aromatique substitué par un groupement activant est ainsi plus réactif que le composé aromatique non substitué. À l'inverse, un composé aromatique substitué par un groupement désactivant est moins réactif. Ces règles ont été énoncé par le chimiste Holleman en 1910, elles sont connues sous le nom de règles de Holleman.
Groupements activants
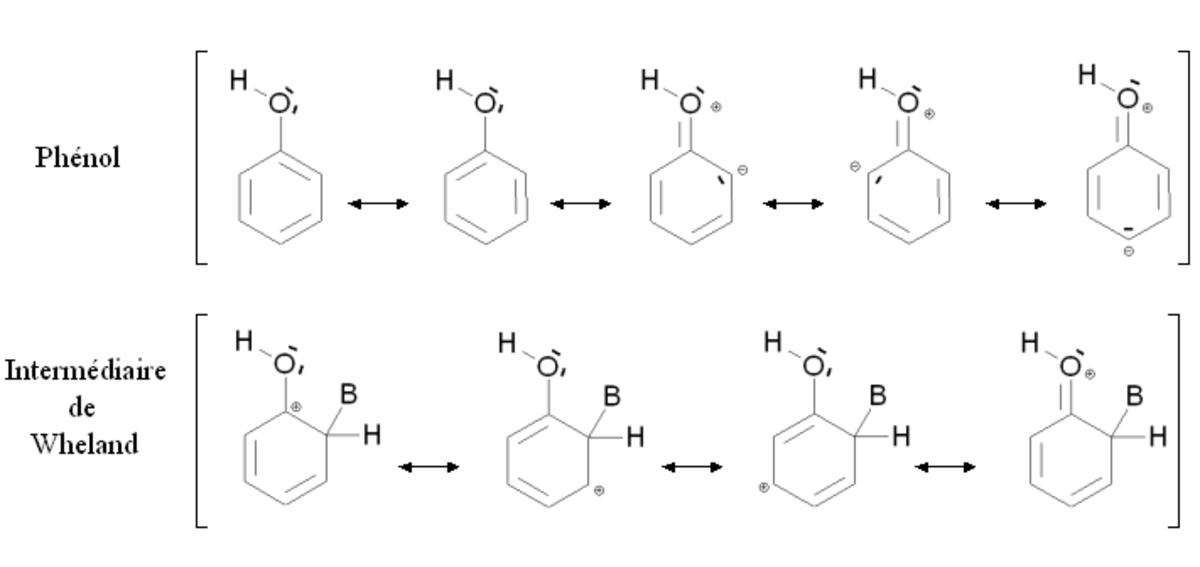
Un groupement activant est un groupement dont la présence augmente la réactivité du cycle aromatique vis-à-vis de la substitution électrophile aromatique par rapport au cycle pour lequel ce groupement est absent. Une substitution d'un cycle aromatique non substitué par un groupement activant conduira fréquemment à une polysubstitution. La réactivité du cycle aromatique sera augmentée s'il faut fournir moins d'énergie pour passer du composé de départ à l'intermédiaire réactionnel (intermédiaire de Wheland), autrement dit si l'écart énergétique entre le composé de départ et l'intermédiaire réactionnel est plus faible. Ce sera notamment le cas des composés mésomères donneurs, comme par exemple le groupement alcool -OH. La figure ci-dessous montre la stabilisation par mésomérie du phénol et de l'intermédiaire de Wheland correspondant :
Le phénol et l'intermédiaire de Wheland sont tous deux stabilisés par mésomérie en délocalisant les électrons du cycle aromatique. Par ailleurs, il est possible d'écrire des formules mésomères mettant en jeu un doublet d'électron de l'atome d'oxygène. Dans le cas du phénol, ces formes mésomères font apparaître des charges formelles sur l'oxygène et un atome de carbone, elles n'induisent donc qu'une faible stabilisation. Au contraire, dans le cas de l'intermédiaire de Wheland, aucune charge supplémentaire n'apparaît : la stabilisation est importante. L'intermédiaire de Wheland est donc plus stabilisé que le phénol par la présence du groupement -OH.
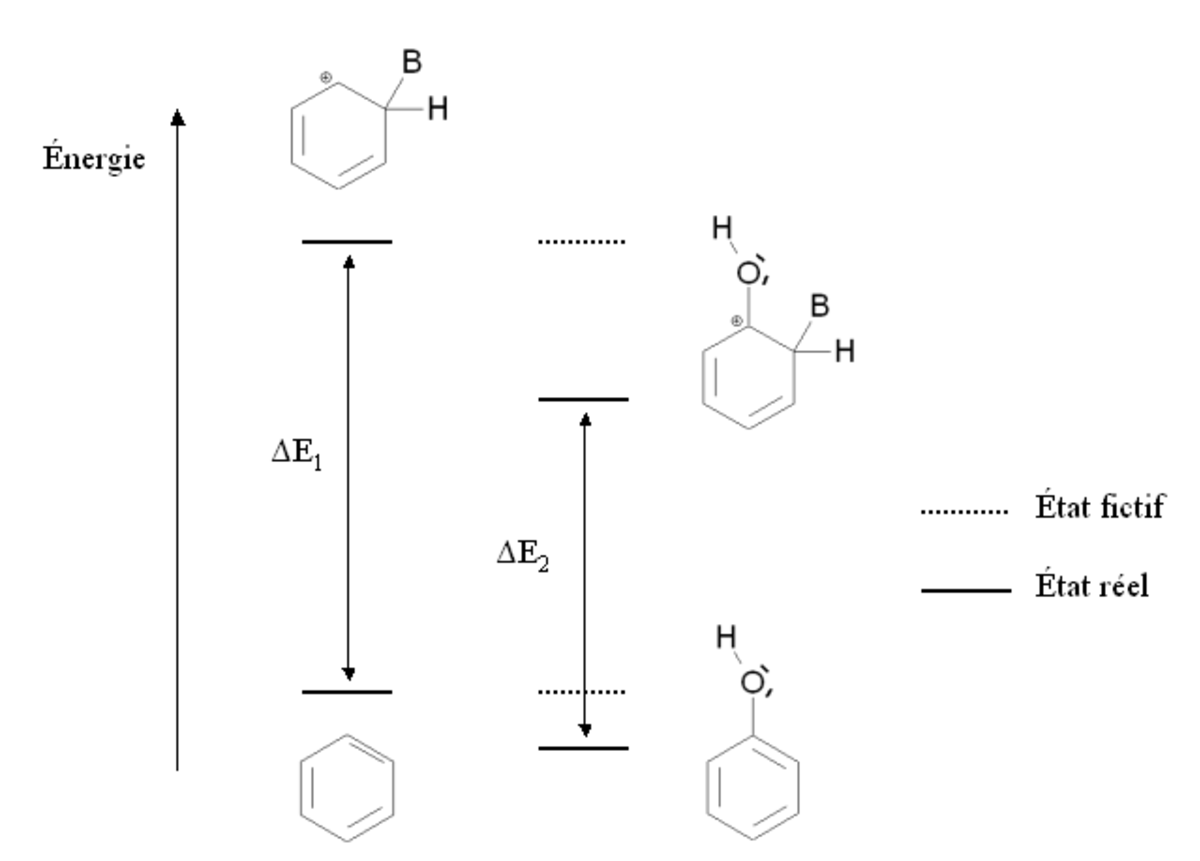
Cette situation est résumée sur la figure ci-contre, par comparaison avec la benzène (cycle aromatique non substitué). Les états fictifs (pointillés) correspondent à une situation où la présence du groupement -OH serait neutre, c’est-à-dire une situation où il n'interviendrait par l'intermédiaire des doublets portés par l'oxygène. Dans ce cas, l'énergie du phénol et de l'intermédiaire de Wheland serait la même que dans le cas du benzène. Les traits pleins correspondent à la situation réelle : l'intermédiaire de Wheland est plus stabilisé que le phénol (son énergie est plus abaissée). En conséquence, l'écart énergétique entre le phénol et l'intermédiaire de Wheland ΔE2 est plus faible que cet écart dans le cas du benzène ΔE1. Le phénol est donc plus réactif que le benzène vis-à-vis de la substitution électrophile aromatique.
Globalement, seront activants tous les groupements qui pourront stabiliser la charge positive de l'intermédiaire de Wheland, soit par mésomérie, soit par effet inductif, donc les groupements mésomères donneurs et inductifs donneurs.
Groupements désactivants
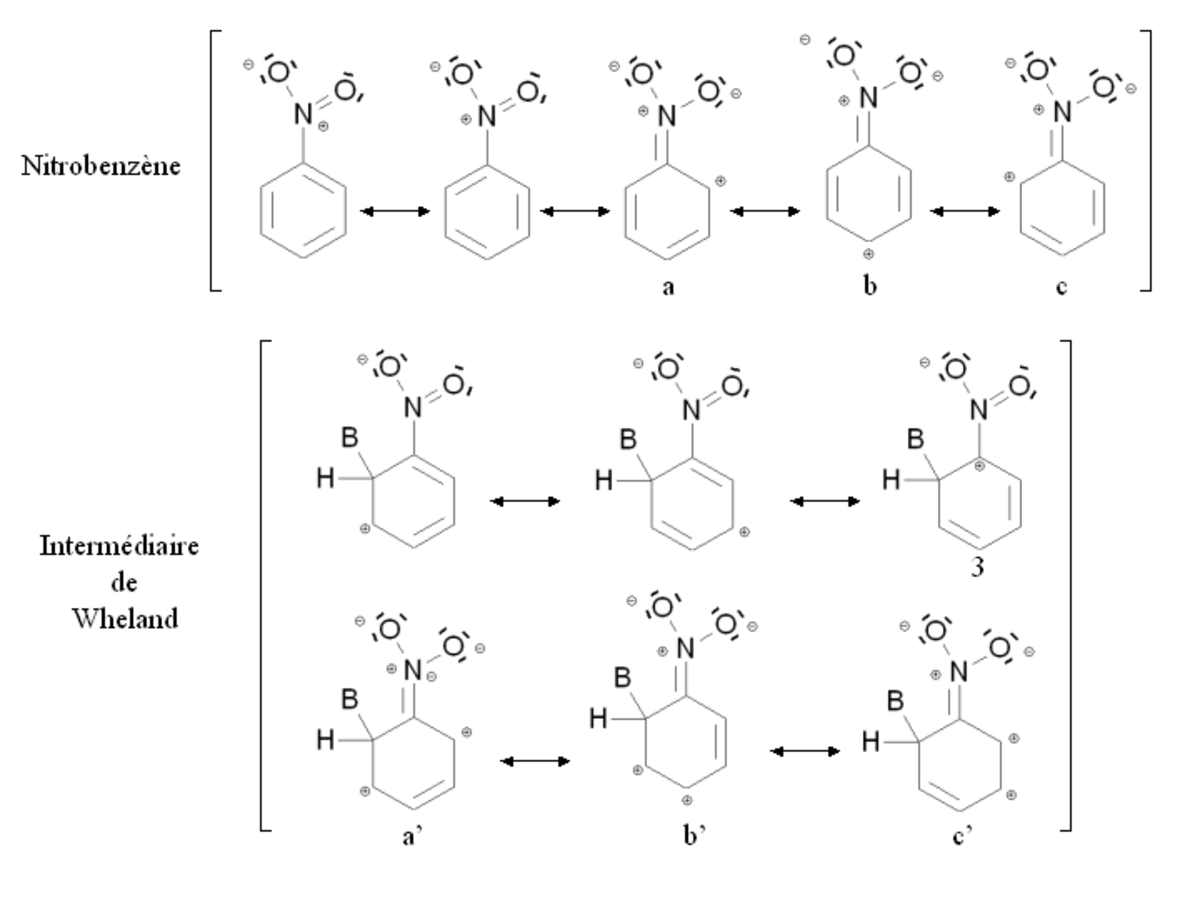
Un groupement désactivant est un groupement dont la présence diminue la réactivité du cycle aromatique vis-à-vis de la substitution électrophile aromatique par rapport au cycle pour lequel ce groupement est absent. Une substitution d'un cycle aromatique non substitué par un groupement désactivant ne conduira que très rarement à une polysubstitution. La réactivité du cycle aromatique sera diminuée s'il faut fournir plus d'énergie pour passer du composé de départ à l'intermédiaire réactionnel (intermédiaire de Wheland), autrement dit si l'écart énergétique entre le composé de départ et l'intermédiaire réactionnel est plus important. Ce sera notamment le cas des composés mésomères attracteurs, comme par exemple le groupement nitro -NO2. La figure ci-dessous montre la stabilisation par mésomérie du nitrobenzène et de l'intermédiaire de Wheland correspondant :
Le nitrobenzène et l'intermédiaire de Wheland sont tous deux stabilisés par mésomérie en délocalisant les électrons du cycle aromatique. Cependant dans le cas de la forme mésomère 3 de l'intermédiaire de Wheland, l'atome de carbone lié au groupement nitro (très électronégatif) est chargé positivement. Cette forme mésomère est donc très peu stabilisante : l'intermédiaire de Wheland est moins stabilisé que le nitrobenzène, et la présence du groupement nitro induit une déstabilisation par rapport à une situation où il serait absent. Par ailleurs, il est possible d'écrire des formules mésomères mettant en jeu un doublet d'électron de l'atome d'azote (a, b, c et a', b', c'). Cependant dans le cas des formes mésomères b' et c' de l'intermédiaire de Wheland, deux charges positives sont portées par des atomes de carbone conjoints, ce qui correspond à une configuration très peu stable. De nouveau, l'intermédiaire de Wheland est moins stabilisé que le nitrobenzène.
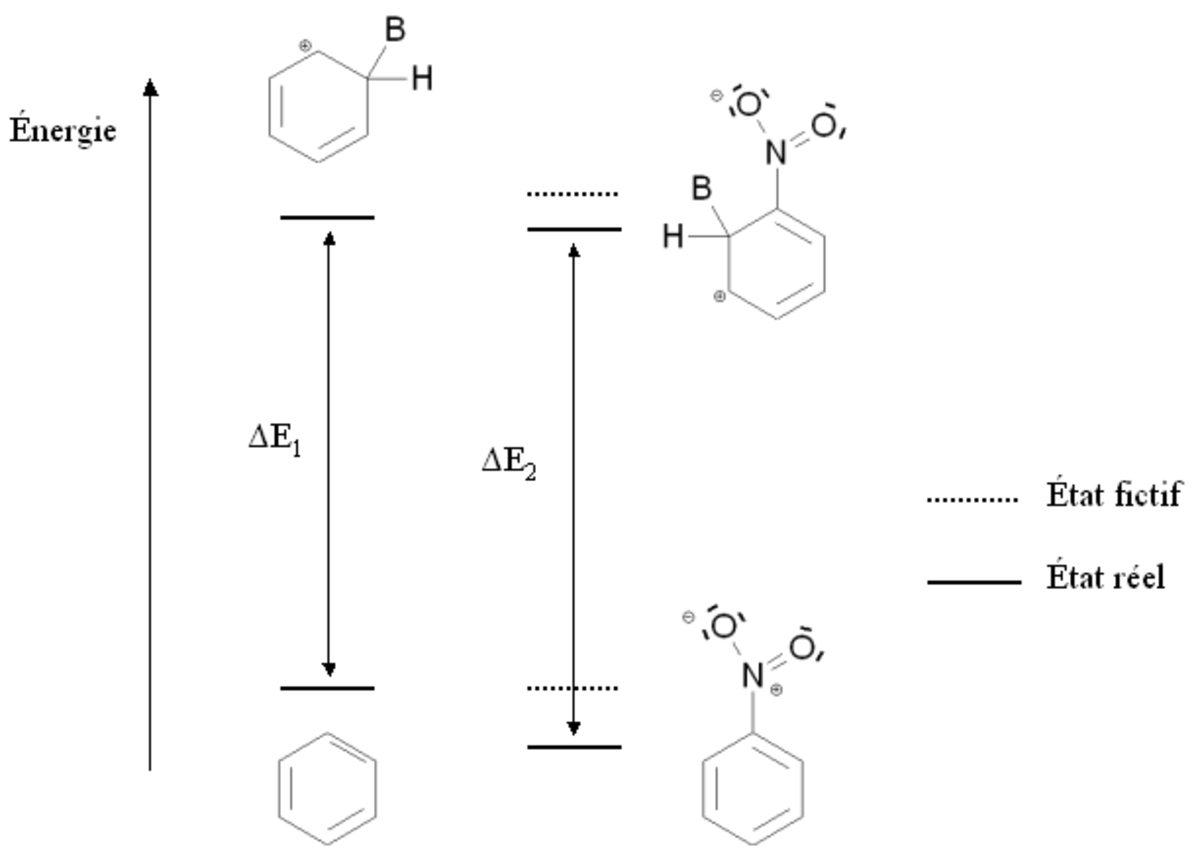
Cette situation est résumée sur la figure ci-contre, par comparaison avec la benzène (cycle aromatique non substitué). Les états fictifs (pointillés) correspondent à une situation où le groupement -NO2 n'interviendrait par l'intermédiaire des doublets portés par l'azote. L'état fictif de l'intermédiaire de Wheland est déstabilisé par rapport au benzène (à cause charge positive dans la formule mésomère 3). En revanche, le nitrobenzène n'est pas déstabilisé par rapport au benzène. Les traits pleins correspondent à la situation réelle : l'intermédiaire de Wheland est mois stabilisé que le nitrobenzène (son énergie est moins abaissée) à cause des charges portées par les atomes de carbone conjoints dans les formules mésomères b' et c'. En conséquence, l'écart énergétique entre le nitrobenzène et l'intermédiaire de Wheland ΔE2 est plus élevé que cet écart dans le cas du benzène ΔE1. Le nitrobenzène est donc moins réactif que le benzène vis-à-vis de la substitution électrophile aromatique.
Globalement, seront désactivants tous les groupements qui pourront déstabiliser la charge positive de l'intermédiaire de Wheland, soit par mésomérie, soit par effet inductif, donc les groupements mésomères attracteurs et inductifs attracteurs.
Bilan : réactivité relative de quelques composés substitués
La réactivité d'un composé aromatique substitué vis-à-vis d'une nouvelle substitution électrophile aromatique dépend donc fortement de la nature du substituant déjà présent. La réactivité est d'autant plus grande que le substituant apporte des électrons au système et stabilise les charges positives (effet mésomère donneur et inductif donneur). Le tableau ci-dessous donne ainsi quelques ordres de grandeurs de réactivité (rapportée à celle du benzène, fixée à 1) de quelques benzènes substitués. Le phénol est ainsi 1000 fois plus réactif que le benzène, et le nitrobenzène 10 000 fois moins.
| substituant | -N(CH3)2 | -OH | -CH3 | -H | -Cl | -COOH | -NO2 |
| réactivité | 9000000 | 1000 | 25 | 1 | 0,3 | 4.10-3 | 1.10-4 |
Régiosélectivité
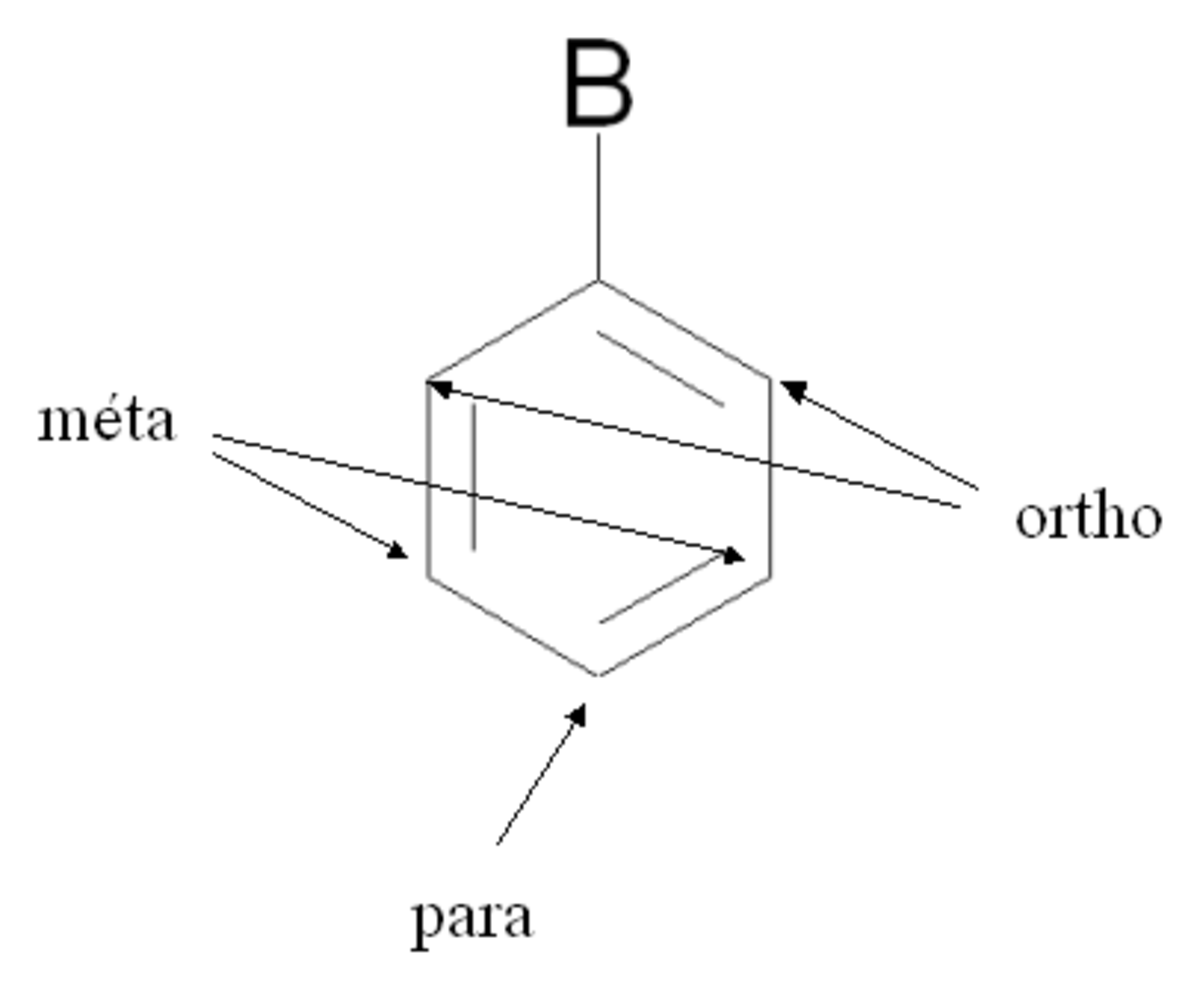
Lorsqu'un composé aromatique substitué subit une seconde substitution électrophile aromatique, l'attaque peut a priori se faire depuis cinq positions. Parmi ces positions, deux sont des positions ortho, deux des positions méta et une position para (voir figure de droite).
De prime abord, on pourrait donc penser que le produit de la réaction est un mélange constitué à 40 % d'isomère ortho, à 40 % d'isomère méta et à 20 % d'isomère para, selon une répartition statistique (2 - 2 - 1). En réalité, ce n'est pas du tout le cas, et la régiosélectivité de la réaction (et donc la nature du produit final) dépend fortement du groupement déjà présent sur le cycle aromatique substitué. Suivant la nature de ce groupement, la seconde substitution pourra se faire quasi exclusivement en meta, ou selon un mélange ortho + para.
Groupements ortho-para orienteurs
Expérimentalement, une substitution électrophile aromatique utilisant comme produit de départ un cycle aromatique substitué par un groupement donneur (mésomère donneur ou inductif donneur) conduira à un mélange d'isomères ortho et para, avec une quantité très faible d'isomère méta. Ce résultat s'explique par des considérations énergétiques simples.
Pour passer du composé de départ à un intermédiaire réactionnel au cours d'une réaction chimique, il faut fournir de l'énergie pour franchir une barrière de potentiel. La vitesse de la réaction sera d'autant plus grande que cette barrière sera faible, et donc que l'intermédiaire réactionnel sera stable. Dans le cas de la substitution électrophile aromatique, on peut considérer avec une bonne approximation que le produit final formé le plus rapidement sera celui dont l'intermédiaire de Wheland sera formé le plus rapidement (réaction sous contrôle cinétique). Il doit donc correspondre à l'intermédiaire de Wheland le plus stable.
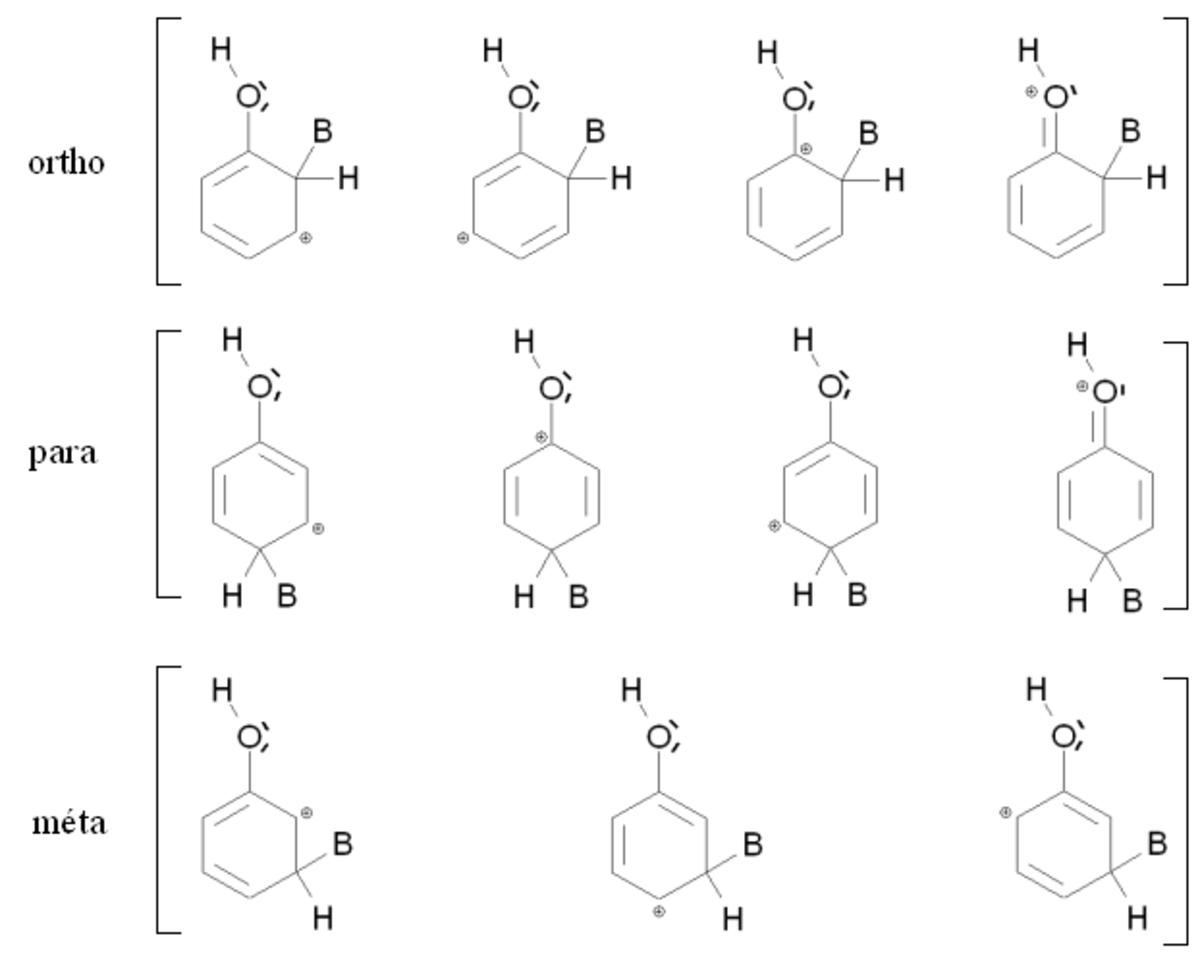
La figure de droite montre les intermédiaires de Wheland correspondant aux composés ortho, méta et para dans le cas où le produit de départ est le phénol (mésomère donneur). Dans les trois cas, l'intermédiaire de Wheland est stabilisé par mésomérie en délocalisant la charge positive sur trois atomes de carbone. Dans le cas des composés ortho et para, la charge est également stabilisée par une mésomérie mettant en jeu un doublet d'électrons de l'atome d'oxygène. Ces deux intermédiaires sont donc nettement plus stables que l'intermédiaire meta, et la réaction conduit à un mélange constitué principalement des isomères ortho et para.
Globalement, un groupement donneur (mésomère donneur ou inductif donneur) sera donc ortho para orienteur. Si ce groupement est très volumineux, le composé final sera majoritairement para (les positions ortho seront difficilement accessibles). Au contraire s'il est faiblement volumineux, la composé ortho sera statistiquement favorisé (2 positions ortho pour une seule position para). Ainsi par exemple, la nitration du toluène (φ-CH3) conduira à un mélange d'isomères ortho (60 %), para (37 %) et méta (2 %) (le substituant est peu volumineux), alors que la nitration du méthoxybenzène (φ-O-CH3) conduira à un mélange d'isomères ortho (34 %), para (65 %) et méta (1 %) (le substituant est relativement volumineux).
Groupements méta orienteurs
Expérimentalement, une substitution électrophile aromatique utilisant comme produit de départ un cycle aromatique substitué par un groupement attracteur (mésomère attracteur ou inductif attracteur) conduira principalement à l'isomère méta, avec une faible quantité d'isomères ortho et para.
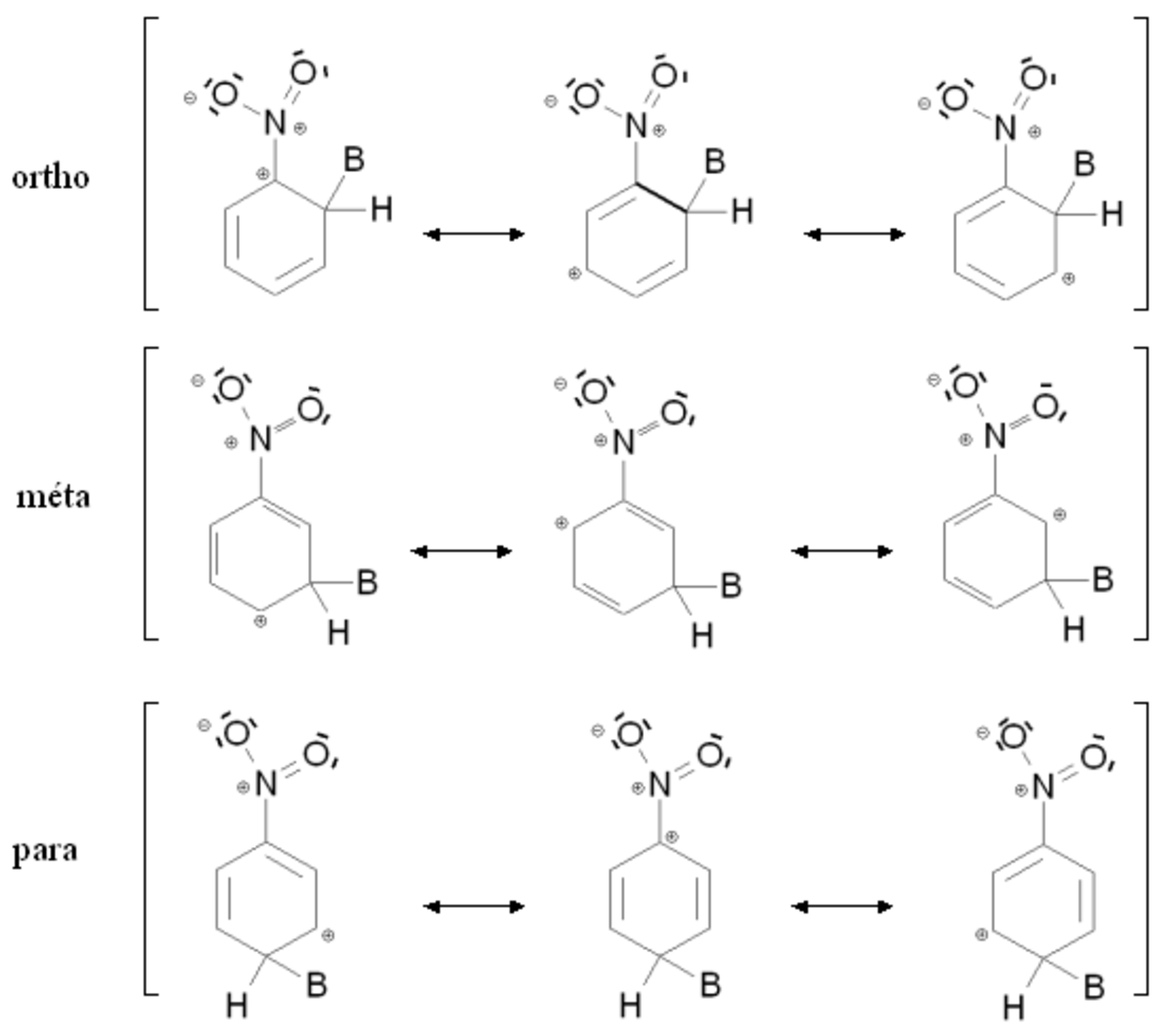
Comme dans le cas des groupements ortho-para orienteurs, ce résultat s'explique par des considérations énergétiques simples en raisonnant sur la stabilité de l'intermédiaire de Wheland. La figure de droite montre les intermédiaires de Wheland correspondant aux composés ortho, méta et para dans le cas où le produit de départ est le nitrobenzène (mésomère attracteur). Dans les trois cas, l'intermédiaire de Wheland est stabilisé par mésomérie en délocalisant la charge positive sur trois atomes de carbone. Le groupement nitro étant attracteur, il ne stabilise jamais la charge positive par mésomérie. Pour l'une des formes mésomères des intermédiaires ortho et para, l'atome de carbone lié au groupement nitro porte une charge positive. Le groupement nitro étant très électronégatif, cette situation est très instable, et cette forme mésomère n'est quasiment pas stabilisante. Les intermédiaires ortho et para sont donc moins stables que l'intermédiaire méta, qui sera donc formé plus rapidement.
Globalement, un groupement attracteur (mésomère attracteur ou inductif attracteur) sera donc méta orienteur. Ainsi par exemple, une seconde nitration du nitrobenzène conduira à 92 % d'isomère méta, 7 % d'ortho et 1 % de para.
Cas particuliers des halogènes
Les halogènes (principalement chlore, brome et iode) constituent un cas particulier, étant à la fois faiblement mésomères donneurs et faiblement inductifs attracteurs. Ces groupements sont faiblement désactivants (le chlorobenzène est environ 3 fois moins réactif que le benzène) mais ortho-para orienteurs.
Tableau récapitulatif
En résumé, les groupements donneurs sont activants (la réactivité est plus importante) et ortho-para orienteurs, et les groupements attracteurs sont désactivants et méta orienteurs. En règle générale, l'effet activant ou désactivant est d'autant plus important que le groupement est plus donneur ou attracteur. Le tableau ci-dessous répertorie les effets sur la réactivité et la régiosélectivité de quelques groupements fréquemment utilisés.
| Activant | Désactivant | |
|---|---|---|
| Puissant | -O-, -OH ortho-para orienteurs | -NO2, -NR3+ (R=H ou alkyle), -CCl3, -CF3 méta orienteurs |
| Moyens | -O-R, -NH-CO-R (R=alkyle) ortho-para orienteurs | -CN, -SO3H, -COOR, -CO-R (R=H ou alkyle) méta orienteurs |
| Faibles | alkyles, aryles ortho-para orienteurs | halogènes ortho-para orienteurs |