Superoxyde dismutase - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
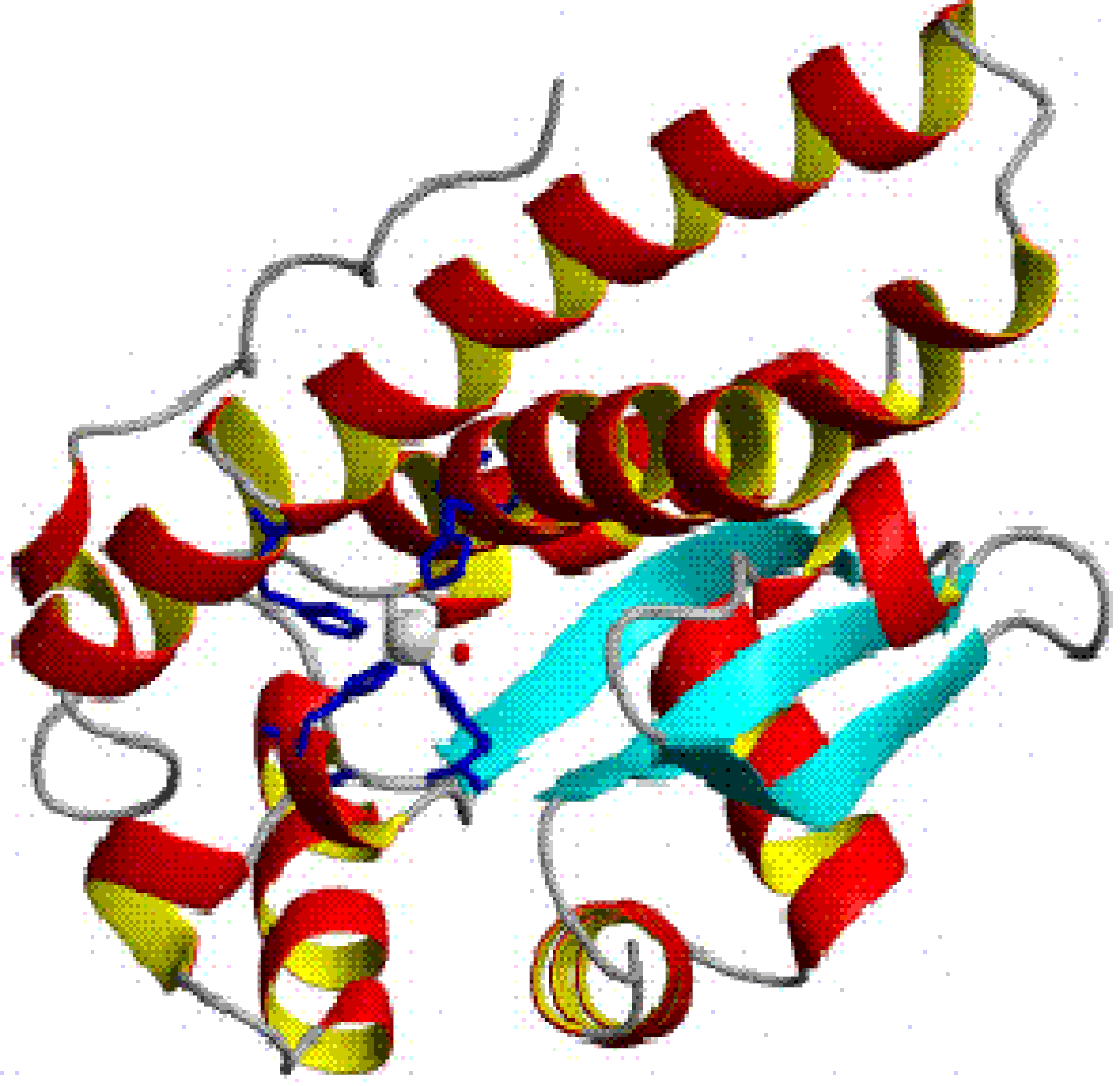
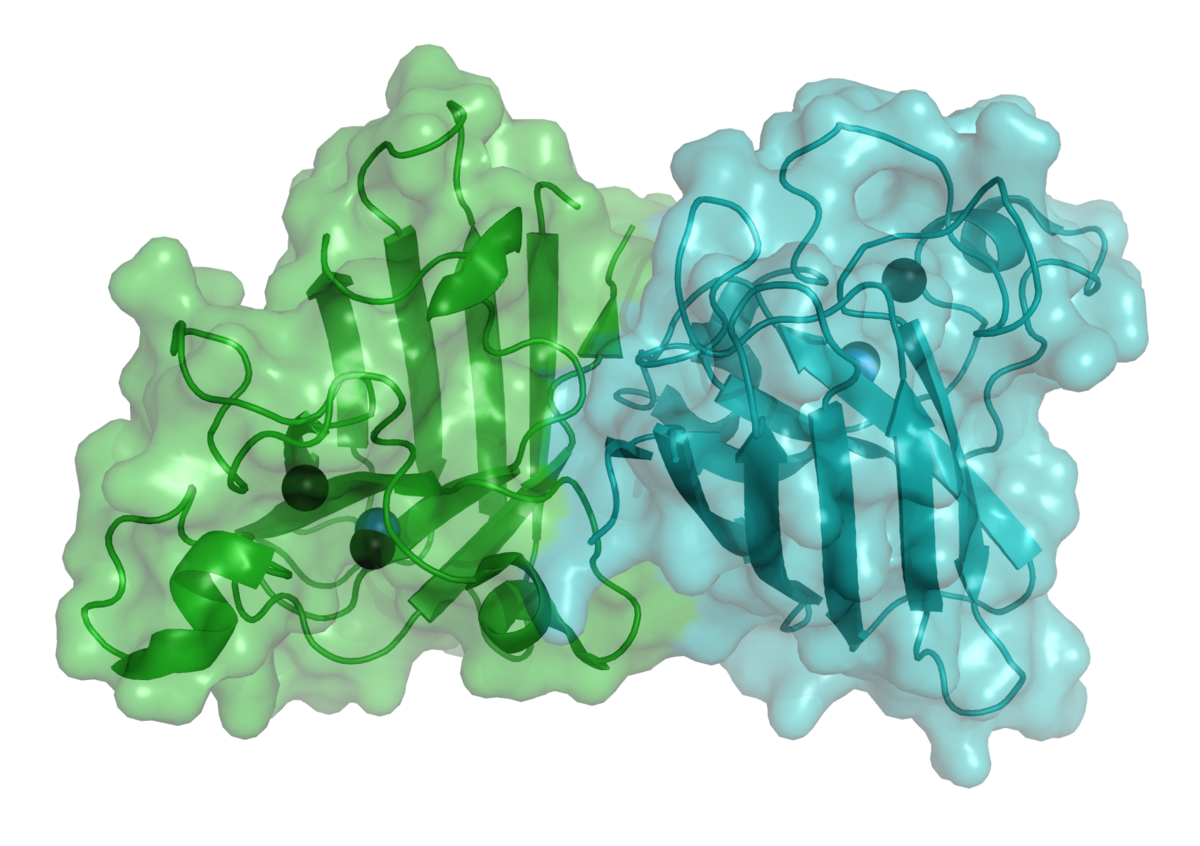
La superoxyde dismutase (SOD, numéro EC : 1.15.1.1), est une métalloprotéine avec une activité enzymatique: la catalyse de la dismutation du superoxyde en oxygène et peroxyde d'hydrogène. Pour cette raison, cette enzyme est une partie importante du système de défense contre les radicaux libres. Elle est présente dans presque tous les organismes aérobies. Une des rarissimes exceptions est Lactobacillus plantarum et les Lactobacillus apparentés, qui n'en possèdent pas et utilisent un mécanisme de défense différent.
Cofacteurs métalliques
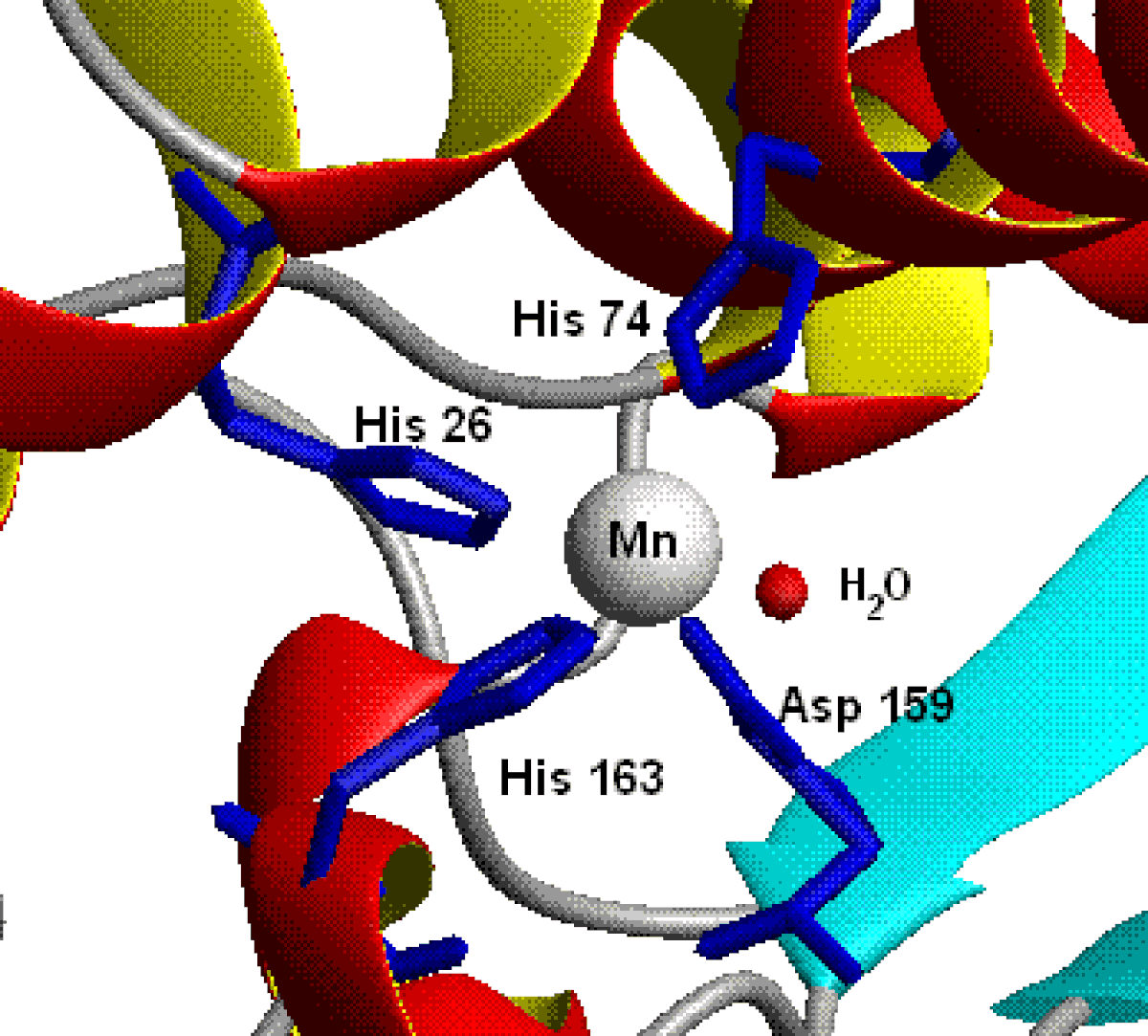
Il existe quatre types de superoxydes dismutases selon les ions cofacteurs : cuivre et zinc ; manganèse ; fer ; nickel.
Réaction catalytique
La dismutation du superoxyde catalysée par les SOD peut être écrite à l'aide des deux demi-réactions suivantes :
- M(n+1)+ − SOD + O2− → Mn+ − SOD + O2
- Mn+ − SOD + O2− + 2H+ → M(n+1)+ − SOD + H2O2.
où M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2).
Considérant ces équations, tout élément métallique impliqué dans un couple redox monoélectronique, dont le potentiel d'oxydo-réduction à pH physiologique est compris entre les potentiels des réactions d'oxydation (-0,33V, en dioxygène) et de réduction (+0,89V en peroxyde d'hydrogène) du superoxyde peut être employé au sein d'une SOD. Bien que ces cations métalliques (excepté le fer(II)) ne possèdent pas un potentiel approprié à l'état libre, les ligands (i.e. histidine, cystéine, aspartate) du centre métallique influent sur le potentiel redox du cation, permettant ainsi la catalyse de la réaction de dismutation du superoxyde.
Dans l'enzyme à cuivre et zinc, le zinc n'a pas de rôle catalytique.
Physiologie
Le radical-anion superoxyde O2-) dismute spontanément en O2 et H2O2 mais, dans les conditions physiologiques, la vitesse de cette réaction bimoléculaire est faible et le temps de vie du superoxyde est suffisamment long pour qu'il puisse soit oxyder des composants des macromolécules biologiques (acides nucléiques, protéines …), soit générer d'autres espèces réactives oxygénées bien plus toxiques que le superoxyde lui-même (telles que le péroxynitrite en réagissant avec NO ou le radical hydroxyle en réagissant avec le H2O2).
Pour éviter la toxicité du superoxyde et de ses dérivés, l'évolution a permis d'obtenir des SOD hautement efficaces. La CuZn-SOD a la plus grande constante de vitesse catalytique connue pour une enzyme, kcat=~109 M-1 s-1). La réaction entre la CuZn-SOD et le superoxyde n'est limitée que par la diffusion du superoxyde vers le site actif de l'enzyme. Les autres SOD sont légèrement moins efficaces (kcat=~108 M-1 s-1.)
Dans les conditions normales, la SOD réduit efficacement la concentration de superoxyde dans les tissus vivants, empêchant la toxicité du superoxyde de se manifester.
Mutations
L'importance physiologique des SOD a été mise en évidence à l'aide d'études réalisées sur des lignées de souris génétiquement modifiées dans lesquelles un des types de SOD a été inactivé.
Effets des mutations :
- Les souris dépourvues de SOD1 (CuZn-SOD cytosolique) développent une grande quantité de pathologies parmi lesquelles des cancers du foie, une accélération de la perte de masse musculaire avec l'âge, une incidence précoce de la cataracte et une espérance de vie réduite.
- Les souris dépourvues de SOD2 (Mn-SOD) meurent quelques jours après la naissance dans des conditions de stress oxydant massif.
- Les souris dépourvues de SOD3 ne présentent, par contre, aucune anomalie visible.