Transformation de Legendre - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La transformation de Legendre est une opération mathématique qui, schématiquement, transforme une fonction définie par sa valeur en un point en une fonction définie par sa tangente.
Les cas classiques d'utilisation de la transformation de Legendre se rencontrent en thermodynamique et en mécanique lagrangienne. En thermodynamique, elle permet de calculer le potentiel thermodynamique adapté à des conditions particulières. En mécanique, elle permet de passer du lagrangien au hamiltonien.
Principe
Soit une fonction d'état E des variables B,D,...,G dont la différentielle s'écrit par exemple dans le voisinage d'un état défini par B = B0,D = D0,...,G = G0 :
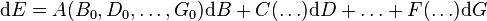
que l'on écrit formellement :
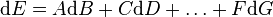
Si F est non nulle autour du point considéré B = B0,D = D0,...,G = G0 , alors pour B,D,... fixés la restriction de la fonction E à la variable G est localement bijective autour de G = G0 pour B = B0,D = D0,.... On peut alors créer une nouvelle fonction d'état E' dépendant cette fois du jeu de variables (B,D...,F) possédant un extremum pour B,D,... fixés autour de F = F(B0,D0,G0) en considérant les variables conjuguées F et G et en posant :
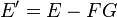
(Si on avait eu dE = AdB + CdD + ... − FdG on aurait posé E' = E + FG)
La différentielle de E' sera alors :
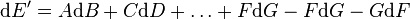
Qui se simplifie sous la forme :
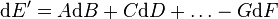
Et nous voyons que la nouvelle fonction d'état E' possède le même nombre de variables indépendantes que la fonction d'état E. La différence réside dans le fait que E se basait sur la variable G alors que E' se base sur la variable F.
Ceci sera particulièrement utile dans le cas ou on dispose des moyens matériels d'imposer au système depuis l'extérieur la valeur de F, qui n'est pas une variable naturelle du système. On crée donc une fonction d'état dans laquelle F devient une variable du système, que l'on peut alors fixer ; Par exemple en thermodynamique, le récipient rigide impose le volume du gaz contenu indépendamment de sa pression (si le récipient est suffisamment solide !), la fonction d'état énergie interne est adaptée pour traiter ce problème. Au contraire , dans le cas ou le récipient n'est pas une bouteille mais par exemple un ballon dégonflé, ce n'est plus le volume qui est imposé de l'extérieur mais bien la pression. Nous voyons aux lignes suivantes que l'on crée à partir de la fonction d'état « énergie interne » une fonction d'état « enthalpie » qui prend en charge ce problème.
Au total, la transformation de Legendre permet en fait de modifier l'ensemble des variables indépendantes pour avoir un ensemble de variables mieux adaptées au problème considéré.
Les variables supplémentaires
On peut définir des enthalpies libres généralisées relatives aux propriétés électriques (ferroélectricité..) ou magnétiques (diamagnétisme, paramagnétisme, ferromagnétisme, ...), et des potentiels chimiques généralisés à plusieurs espèces chimiques différentes exactement de la même façon.
Exemple des fonctions thermodynamiques
Considérons, à titre d'exemple, l'énergie interne d'un système dont l'une des principales différentielles peut s'écrire :
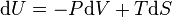
Qui serait bien adapté à un contexte ou l'on maîtrise bien le volume V et l'entropie S en tant que variables indépendantes
- Compte tenu de la présence du terme − PdV, nous pouvons faire une transformation de Legendre en ajoutant PV à la fonction d'état U.
- Compte tenu de la présence du terme TdS, nous pouvons faire une transformation de Legendre en enlevant TS à la fonction d'état U.
En ajoutant PV
Si l'on ajoute PV, on obtient une nouvelle fonction d'état H que l'on appelle enthalpie.
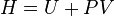
Sa différentielle est alors :
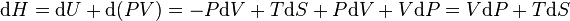
Et nous voyons que l'on a obtenu une fonction d'état H bien adapté à un contexte ou l'on maîtrise la pression P et l'entropie S en tant que variables indépendantes.
En retranchant TS
Si l'on retranche TS, on obtient une nouvelle fonction d'état F que l'on appelle énergie libre.
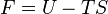
Sa différentielle est alors :
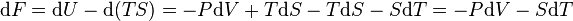
Et nous voyons que l'on a obtenu une fonction d'état F bien adaptéE à un contexte ou l'on maîtrise le volume V et la température T en tant que variables indépendantes comme les réactions chimiques à volume constant et à température constante. C'est le cas si l'on provoque une réaction chimique entre plusieurs gaz dans une bombe calorimétrique avec des produits gazeux et si l'on ramène la température des produits à la température qu'avaient les réactifs avant la réaction.
En ajoutant PV et en retranchant TS
On peut, bien sur, faire les deux opérations simultanément. Cette transformation de Legendre nous permet d'obtenir une autre fonction d'état G que l'on appelle enthalpie libre.
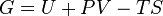
Sa différentielle est alors :
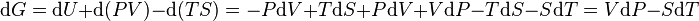
Et nous voyons que l'on a obtenu une fonction d'état G bien adaptée à un contexte ou l'on maîtrise la pression P et la température T en tant que variables indépendantes comme les réactions chimiques à pression constante et à température constante. C'est le cas si l'on provoque une réaction chimique à l'air libre, c'est-à-dire soumise à la pression atmosphérique et si l'on ramène la température des produits à la température qu'avaient les réactifs avant la réaction.
Le cas du potentiel chimique
La différentielle exacte de l'énergie interne dans ses variables naturelles est :
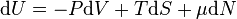
ou N est le nombre de particules du système, qu'on peut éventuellement faire varier ; La résultante de la transformation de Legendre par rapport à toutes les variables extensives naturelles V,S,N est la fonction grand potentiel définie par :
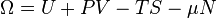
où μ est le potentiel chimique de l'espèce considérée.