Calcul d'incertitude - Définition
Le calcul d'incertitude permet d'évaluer correctement les erreurs qui se produisent lors de mesures liées à la vérification d'une relation entre différentes grandeurs physiques. Les instruments de mesure n'étant pas de précision infinie, les mesures faites pendant une expérience ne sont pas exactes. Il faut donc évaluer ces incertitudes pour répondre à la question : " la relation n'est pas vérifiée exactement parce qu'elle est fausse ou parce que les mesures sont incertaines ? " On en déduit des marges d'erreurs, en dehors desquelles la relation sera invalidée. Cela fait partie intégrante de la méthode scientifique.
Utilisation des différentielles totales exactes
Une loi physique s'exprime par une relation algébrique entre un certain nombre de grandeurs mesurables :
Exemples simples : surface et volume
- Le calcul de la surface d'un rectangle de côtés L et l:
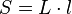
devient lorsque les côtés deviennent L+dL et l+dl:
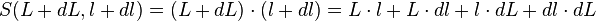
- et donc la variation de la surface dS peut s'écrire :
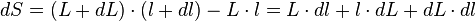
- que l'on approche par :
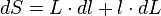
car dL.dl est négligeable.
- Noter que
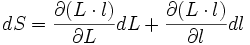
car:
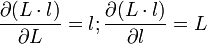
- et donc:
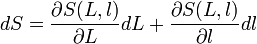
- de même la variation de volume d'une boîte de côtés x, y, z de volume V=xyz :
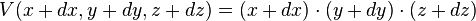
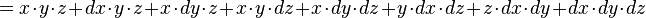
- peut s'écrire :
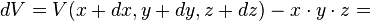
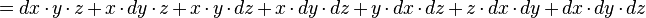
- que l'on approche par :
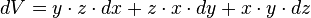
- Noter que
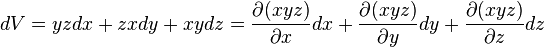
car:
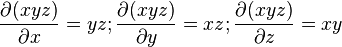
- et donc:
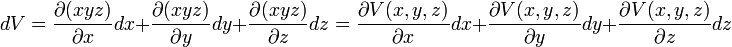
La variation d'une fonction f(x,y,z)
Et plus généralement, pour le calcul de la variation d'une fonction f(x,y,z).
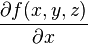
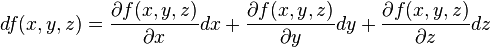
la loi des gaz parfaits
Prenons par exemple la loi des gaz parfaits reliant :
- P : la pression du gaz
- V : le volume occupé par le gaz
- n : la quantité de gaz en moles (1 mole = 6,022 1023 molécules)
- R : la constante des gaz parfaits = 8,314 J.K-1.mol-1
- T : la température absolue du gaz, en kelvin.
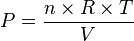
Écrivons sa différentielle :
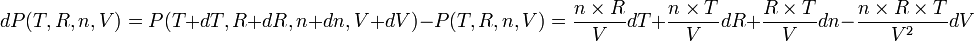
la variation la plus grande s'obtiendra lorsque les 4 termes ci-dessus s'ajouteront:
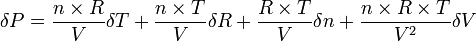
Noter que l'on a dans ce cas particulier :
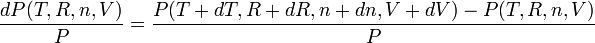
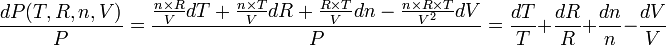
et donc dans l'absolu:
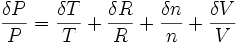
Noter aussi que l'on peut utiliser la "différentielle logarithmique" :
en effet :
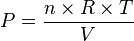
donc :
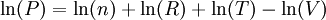
donc en derivant :
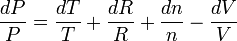
Cette méthode plus rapide, s'applique lorsqu'on cherche à faire la différentielle d'une fonction, quotient ou produit de plusieurs variables.
Les incertitudes relatives s'ajoutent lorsque l'on a un produit de variables et ce résultat est remarquable car il est facile à retenir: les incertitudes relatives s'ajoutent lorsque la formule ne comporte que des produit (au sens large: une division est un produit par l'inverse).
Utilisation de calculatrices
Ce qui vient d'être fait peut être fait par calcul direct avec une calculatrice ou un tableur (sur ordinateur):
Utilisation de graphes et de barres d'erreurs
Reprenons l'exemple de l'étude des gaz parfaits. Si l'on trace P en fonction de 1/V, on obtiendra théoriquement une droite passant par l'origine, avec comme pente RnT : y=(RnT).x.
n et T étant maintenus constants (l'enceinte ou cellule de mesure contenant le gaz étant sans fuite et thermostatée avec T connu à 0,2%), P étant mesuré, en utilisant un manomètre, avec 5% d'erreur relative, et V étant mesuré avec 2% d'erreur relative, pour chaque point de mesure expérimentale (P,1/V), on trace des barres d'erreurs représentant l'erreur absolue.
Un programme de " fit " ou d'ajustage de courbe, basé sur l'idée de minorer la distance de la droite (ou courbe) à tous les points expérimentaux, permet de tracer la droite théorique et de calculer sa pente nRT avec un coefficient de confiance r² proche de l'unité, si le fit est bon. On utilise la "méthode des moindres carrés" : le programme utilisé somme les distances entre la droite et chaque point, le minimum de cette somme correspondant à la meilleure droite de régression.
Dans le cas de figure ci dessus, on obtient ainsi nRT= 2.54 (1 ± 0.07) Joule
Ceci permet de dire que à n et T constants, l'expérience confirme que PV est constant à 7% près pour le gaz étudié et que pour améliorer ce résultat, il faut mesurer V à mieux que 5%.