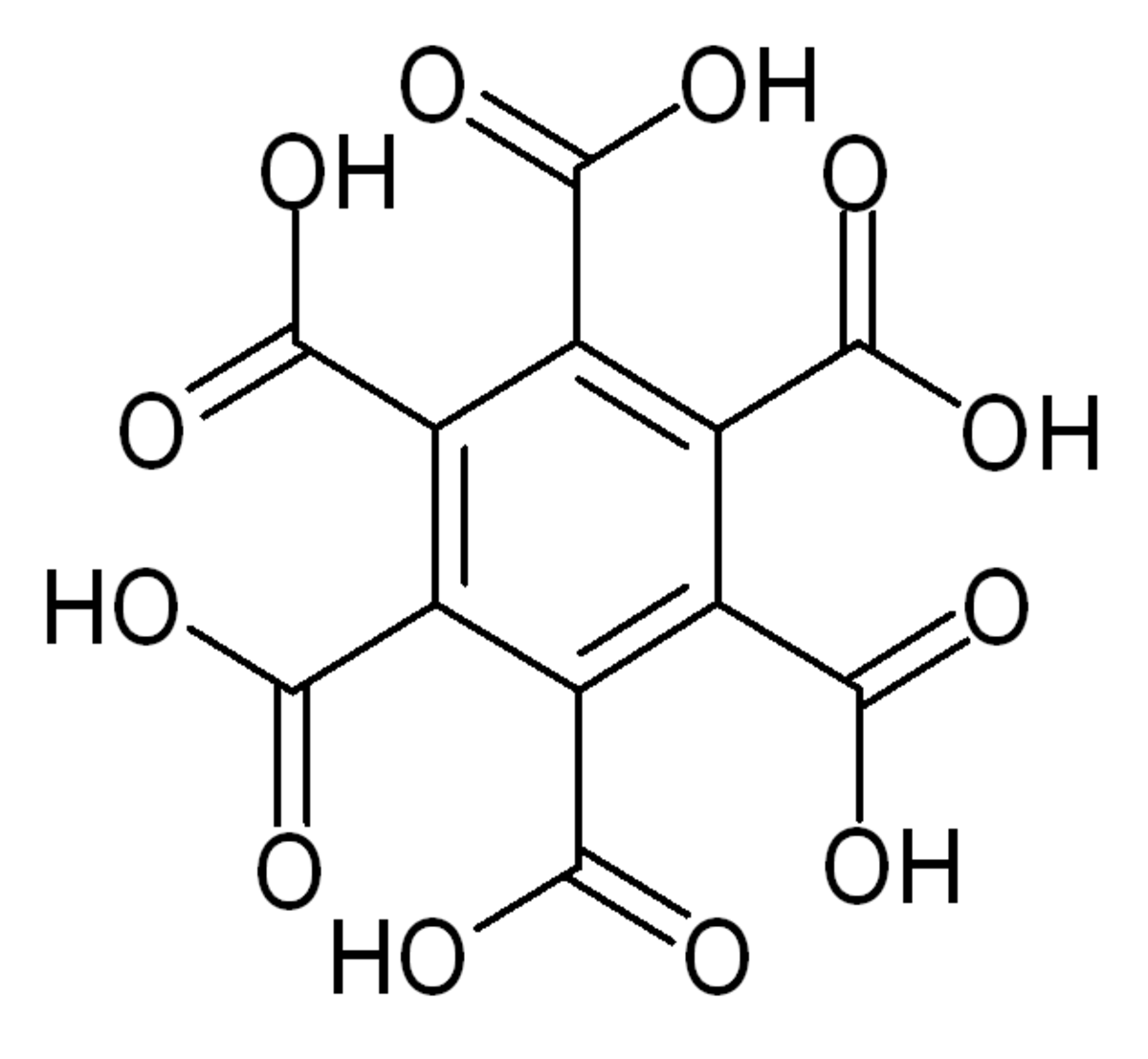
Acide mellitique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Acide mellitique | ||
|---|---|---|
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | acide graphitique | |
| No CAS | ||
| PubChem | ||
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule brute | C12H6O12 | |
| Masse molaire | 342,1688 ± 0,0136 g·mol-1 | |
| pKa | pKs1 = 1,40 pKs2 = 2,19 | |
| Propriétés physiques | ||
| T° fusion | >300 °C | |
| T° ébullition | 678 °C (calc.) | |
| Masse volumique | 1,68 g·cm-3, 2,078 (calc.) | |
| Précautions | ||
| | ||
| ||
| Phrases R : 36/37/38, | ||
| Phrases S : 26, 36, | ||
| | ||
L'acide mellitique ou acide graphitique ou acide benzène hexacarboxylique est un acide carboxylique de formule brute C12H6O12 qui consiste en six groupes acide carboxylique qui substituent complétement un noyau benzénique. Il a été découvert en 1799 par M. H. Klaproth dans un minéral, la mellite (pierre miel) qui est en fait le sel d'aluminium de cet acide. Ses esters et sels s'appellent mellitate.
Préparation
L'acide mellitique est préparé par chauffage de mellite avec du carbonate d'ammonium (en), (NH4)2CO3 puis en éliminant par évaporation l'excès d'ammonium et en ajoutant de l'ammoniac, NH3 à la solution. Le précipité d'alumine est filtré, le filtrat est évaporé et le sel ammonium de l'acide est purifié par recristallisation. Ce sel d'ammonium est converti en sel de plomb par précipitation avec de l'acétate de plomb, Pb(CH3-COO)2 et est décomposé en l'acide par traitement avec du sulfure d'hydrogène, H2S. L'acide peut aussi être préparé par oxydation de carbone pur ou d'hexaméthylbenzène, (CCH3)6, à froid avec une solution alcaline de permanganate de potassium, KMnO4 ou avec de l'acide nitrique concentré à chaud.
Propriétés et réactions
L'acide mellitique cristallise en fines aiguilles soyeuses et est soluble dans l'eau et l'éthanol. C'est un composé chimique très stable : ni le chlore, ni l'acide nitrique concentré, ni l'acide iodhydrique (HI) n'ont d'action sur lui. il se décompose par chauffage en dioxyde de carbone, CO2 et en acide pyromellitique, C10H6O8. Quand il est chauffé avec du carbonate de calcium, CaCO3, il donne du CO2 et du benzène, C6H6. Une longue réaction de l'acide avec le pentachlorure de phosphore, PCl5 résulte en la formation du chlorure d'acide qui cristallise en aiguilles fondant à 190 °C.
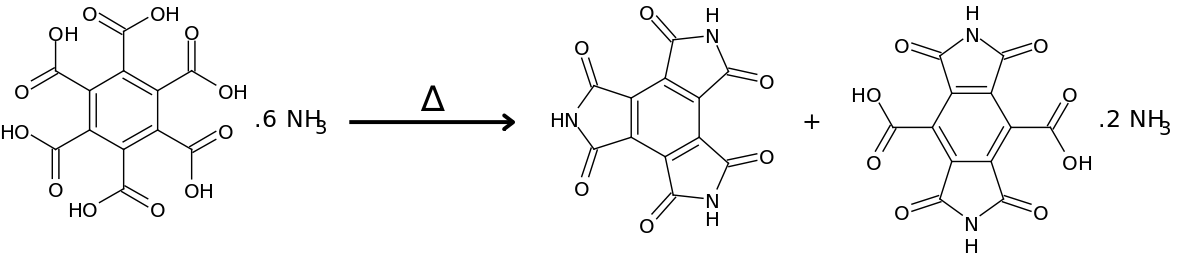
Par chauffage du sel d'ammonium de l'acide à 150-160°C, un mélange composé principalement de triimide mellitique, C6(CONHCO)3, et d'euchroate d'ammonium, C12H4N2O8.2NH3 est obtenu. Ce mélange peut être séparé par dissolution de l'euchroate dans l'eau. Le triimide mellitique est une poudre amorphe blanche insoluble dans l'eau et l'éthanol.
Du fait de la grande stabilité de l'acide mellitique et de ses sels, ils sont le point final de l'oxydation des hydrocarbures aromatiques polycycliques présents dans le système solaire et ainsi ils sont des substances organique possible dans le sol martien.
Les mellitates (et d'autres sels d'acides benzène polycarboxyliques) de fer et de cobalt ont des propriétés magnétiques intéressantes.