Alumine - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Alumine | |
|---|---|
| |
| Général | |
| Synonymes | oxyde d'aluminium bauxite |
| No CAS | |
| No EINECS | |
| PubChem | |
| SMILES | |
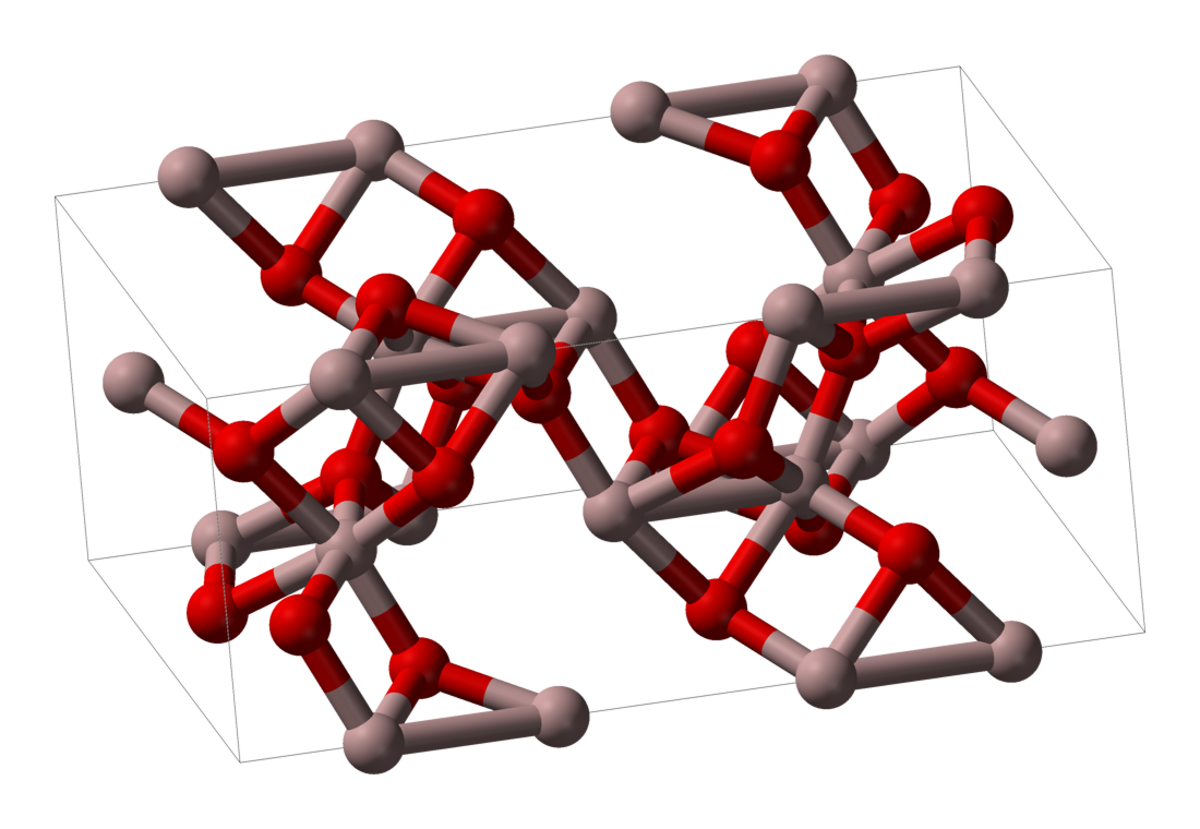
| Apparence | poudre blanche, cristaux hexagonaux |
| Propriétés chimiques | |
| Formule brute | Al2O3 |
| Masse molaire | 101,9613 ± 0,0009 g·mol-1 |
| Propriétés physiques | |
| T° fusion | 2 054 °C |
| T° ébullition | 3 000 °C |
| Solubilité | dans l'eau : nulle |
| Masse volumique | 3,97 g·cm-3 |
| Conductivité thermique | 10,9 W·m-1·K-1 (500 °C); 6,2 W·m-1·K-1 (1 000 °C) |
| Thermochimie | |
| S0 | 67,24 J·K-1·mol-1 |
| S0 | 50,92 ± 0,10 J·K-1·mol-1 |
| ΔH0 | -1 620,57 kJ·mol-1 |
| ΔH0 | -1 675,7 ± 1,3 kJ·mol-1 |
| Cp | 795,6 J·K-1·kg-1 (25 à 1 800 °C) |
| Précautions | |
| | |
| Produit non contrôlé | |
| Écotoxicologie | |
| DL | rats >5 000 mg·kg-1 |
| | |
L’alumine ou oxyde d’aluminium, de formule chimique Al2O3, est un composé chimique qui existe à l'état naturel dans la bauxite, sous forme d'alumine hydratée mélangée avec de l'oxyde de fer.
L'alumine a été isolée en 1754 par le chimiste allemand Marggraf à partir de l'alun. C'est Louis Guyton de Morveau (1737-1816), collaborateur de Lavoisier, qui baptisa alumine l'un des sulfates contenu dans l'alun.
L'extraction de l'alumine de la bauxite est réalisée suivant un procédé chimique appelé procédé Bayer inventé par l'Autrichien Karl Josef Bayer. La bauxite y est attaquée par la soude à haute température et sous pression. La première usine à exploiter ce procédé est l'usine de Gardanne (anciennement Pechiney) en 1894. Cette usine produit toujours à ce jour des alumines hydratées et calcinées suivant ce procédé.
L'alumine est exploitée industriellement pour obtenir de l'aluminium par le procédé électrolytique Héroult-Hall. Elle est aussi utilisée comme matériau réfractaire (résistant aux très fortes températures) et comme céramique, et peut être également utilisée sous forme de corindon pour fabriquer des abrasifs.
Plusieurs pierres précieuses sont à base d'alumine anhydre, colorée ou non par des oxydes métalliques : rubis, topaze, saphir.
Propriétés de l'alumine
| Propriété | Valeur |
|---|---|
| Coefficient de dilatation à 25 °C | 7,1 10-6 K-1 |
| Conductivité thermique à 25 °C | 0,46 J.cm-1.s-1K-1 |
| Constante diélectrique à 25 °C | 10,6 |
| résistivité à 14 °C | 1019 Ω.cm |
De par ses propriétés physiques, l'alumine qui se forme naturellement à la surface de l'aluminium par exposition au dioxygène de l'air, forme, contrairement à la rouille dans le cas du fer, une couche hermétique protectrice qui empêche le reste de l'aluminium d'être oxydé.