Calcul des titres et des volumes d'alcools - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Le calcul des titres et des volumes d'alcools est utilisé en distillation car on ne peut pas prévoir avec précision le résultat (titre alcoolique et volume) d'un mélange de deux liquides hydro-alcooliques. La différence de force des liaisons intermoléculaires (liaisons hydrogène) entre les molécules d'eau et les molécules d'alcool (éthanol) entraine des variations de volume massique en fonction du titre alcoolique qui doivent être prises en compte. La table des densités, utile aussi pour les pesées d'alcool, permet de calculer ces variations de volume massique.
Alcoométrie volumique
| % | +0,5 | +1 | +2 | +3 | +4 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 99820 | 99744 | 99670 | 99596 | 99523 | 99451 | 99381 | 99311 | 99241 | 99173 |
| 5 | 99106 | 99039 | 98973 | 98908 | 98843 | 98779 | 98716 | 98654 | 98592 | 98531 |
| 10 | 98471 | 98411 | 98352 | 98294 | 98235 | 98178 | 98121 | 98064 | 98008 | 97952 |
| 15 | 97897 | 97842 | 97787 | 97733 | 97679 | 97625 | 97571 | 97517 | 97463 | 97409 |
| 20 | 97356 | 97302 | 97248 | 97194 | 97140 | 97086 | 97031 | 96976 | 96921 | 96866 |
| 25 | 96810 | 96753 | 96697 | 96639 | 96581 | 96523 | 96464 | 96404 | 96344 | 96283 |
| 30 | 96221 | 96159 | 96095 | 96031 | 95966 | 95901 | 95834 | 95766 | 95698 | 95629 |
| 35 | 95559 | 95488 | 95415 | 95342 | 95269 | 95194 | 95118 | 95041 | 94963 | 94884 |
| 40 | 94805 | 94724 | 94642 | 94559 | 94476 | 94391 | 94306 | 94219 | 94132 | 94043 |
| 45 | 93954 | 93864 | 93773 | 93681 | 93588 | 93495 | 93400 | 93305 | 93209 | 93112 |
| 50 | 93014 | 92916 | 92816 | 92716 | 92616 | 92514 | 92412 | 92309 | 92206 | 92101 |
| 55 | 91996 | 91891 | 91784 | 91677 | 91570 | 91462 | 91353 | 91243 | 91133 | 91023 |
| 60 | 90911 | 90800 | 90687 | 90574 | 90460 | 90346 | 90231 | 90115 | 89999 | 89882 |
| 65 | 89765 | 89647 | 89528 | 89409 | 89289 | 89169 | 89048 | 88926 | 88803 | 88680 |
| 70 | 88556 | 88432 | 88306 | 88181 | 88054 | 87927 | 87799 | 87670 | 87540 | 87410 |
| 75 | 87279 | 87148 | 87015 | 86882 | 86748 | 86613 | 86478 | 86341 | 86204 | 86066 |
| 80 | 85927 | 85787 | 85646 | 85505 | 85362 | 85219 | 85074 | 84929 | 84782 | 84634 |
| 85 | 84485 | 84335 | 84184 | 84031 | 83877 | 83721 | 83564 | 83405 | 83245 | 83082 |
| 90 | 82918 | 82752 | 82583 | 82413 | 82239 | 82063 | 81885 | 81703 | 81518 | 81330 |
| 95 | 81138 | 80942 | 80742 | 80537 | 80327 | 80112 | 79890 | 79662 | 79425 | 79180 |
| 100 | 78924 |
On appelle alcool une solution hydro-alcoolique dont le titre en éthanol varie de 0 à 100 %. On nomme Ρ sa masse volumique et T son titre en pourcentage volumique à 20 °C (noté °). À 20 °C la masse volumique de l'air vaut 1,20 g/l à la pression normale.
Masse volumique à 20 °C de l'alcool à 66,80° = 89409 -- 3/5 (89409-89289) = 89337 cg/l.
Le mélange d'un volume V d'alcool de titre T et d'un volume V d'alcool de titre T donne, après refroidissement et dissipation des bulles d'air, un alcool de titre T de volume V inférieur à V+V. On dit qu'un alcool a été réduit ou l'autre remonté. Les volumes étant à la température du titre (20 °C), la définition des titres et des masses volumiques conduit à deux égalités qui expriment la conservation du volume d'alcool pur extractible et la conservation de la masse :
Calcul de deux volumes
Si l'on exprime V avec la première égalité et avec la seconde on obtient une équation sans V d'où l'on tire V ,et ensuite V en permutant les indices :
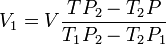
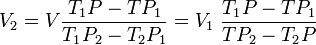
On peut aussi exprimer V en fonction de V et V en fonction de V ou de V .Toute recherche de deux volumes d'un mélange dont les trois titres sont connus trouve ici sa solution. Les calculs sont simplifiés en cas de dilution dans l'eau puisque T est nul.
Exemple : pour remonter à 55° 1 litre d'alcool à 20° avec de l'alcool à 90° on va exprimer V et V en fonction de V :
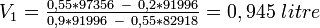
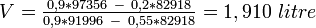
On peut aussi obtenir V en reportant 0,9450 dans l'expression de TV ou de PV.
Si l'on opère à 15 °C, le litre d'alcool à 20° devient 0,998 litre ; il faut le mélanger à 0,940 litre d'alcool à 90° pour obtenir 1,902 litre d'alcool à 55°.
Le coefficient de dilatation cubique du verre Pyrex est 0,00001/°C mais celui du polyméthylpentène est trente-quatre fois plus grand ; à 15 °C il faut mesurer 0,94 x 1,0017 = 0,942 litre d'alcool dans un récipient en P.M.P gradué pour 20 °C.
La contraction rapportée à V est
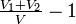
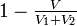
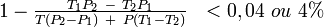
La très petite “contraction” d'un mélange d'alcools faibles peut être négative : le changement de courbure du graphe de Ρ de T explique cela. S' il n'y avait ni retrait ni expansion la courbe serait droite.
Méthode itérative
Si on cherche un volume et un titre il faut appliquer une méthode itérative ; c'est-à-dire évaluer le volume au moyen de l'approximation V = V+V ,puis le titre approché avec l'expression de TV et, avec la table, la masse volumique. En déduire une meilleure évaluation du volume avec l'expression de PV et continuer jusqu'à obtenir deux valeurs du titre égales à l'incertitude près (au mieux 0,05° si les composants du mélange sont titrés à l'alcoomètre).
Exemple : à 20 °C, que faut il verser dans une bombonne de dix litres à moitié pleine d'alcool à 70° pour la remplir d'alcool à 45° ?
V = 5 . . . . . T = 20 . .. . P = 97356
V = 5,1025 . T = 19,60 . P = 97399
V = 5,1003 . T = 19,61 . P = 0,97398 kg/l et on retient 5,100 litres à 19,6°.
Si on préfère peser l'alcool de masse PV = 4,968 kg, la masse lue en kilogramme entre 9 et 31 °C est, sous pression normale,
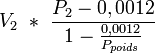
Elle vaut 4,962 kg si on compte 7 kg/l pour les poids.
À 20 °C on peut aussi mélanger les cinq litres à 70° avec cinq litres à 20° et attendre le refroidissement à 20 °C pour ajuster en une ou deux fois le volume avec de l'eau.